商机详情 -
江苏细胞基因治疗产品用宿主细胞蛋白(HCP)残留检测
来源:
发布时间:2025年08月29日
为什么定制化试剂盒是宿主细胞蛋白残留检测的优先选择?原因之一是来源特定工艺下抗原及校准品更具代表性。不同生物制品的上游生产工艺,包括培养基,培养条件,收获时机等差异,均会导致产生的HCPs的蛋白种类、丰度以及蛋白翻译修饰不同,因此进入到下游纯化工艺的HCP类型也随之发生变化,尤其是与药物主成分共纯化的HCPs会成为优势蛋白而存在于药物原液或制剂中。HCP定制化ELISA检测试剂盒通常选取实际生产工艺中上游发酵后的样品进行抗原及校准品的制备,所制备的校准品可以较为充分地反映实际生产工艺中的HCP,减少因抗原校准品种类不足导致的漏检以及定量不准确的风险。
HCP检测的经典方法是ELISA法,但该方法在检测过程中存在漏检风险,需要对试剂盒抗体进行抗体覆盖率评估。江苏细胞基因治疗产品用宿主细胞蛋白(HCP)残留检测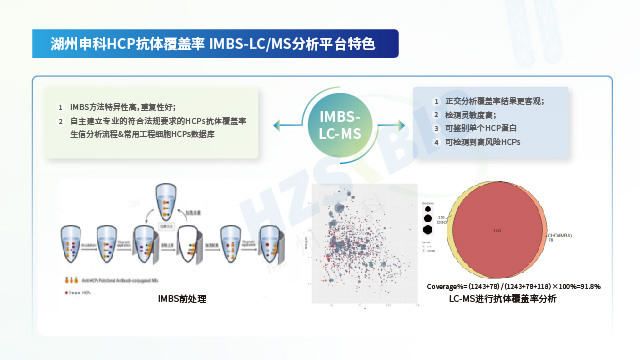
为什么定制化试剂盒是宿主细胞蛋白残留检测的优先选择?这与检测准确性和药物安全性密切相关。HCP ELISA 检测作为多分析物检测方法,其结果准确性高度依赖校准品、抗体质量及检测方法建立。定制化 HCP ELISA 检测试剂盒的关键优势在于,它基于更具代表性的 HCP 抗原免疫动物,由此产生的 HCP 抗体针对性更强。这种针对性抗体能极大降低 HCP 漏检风险,尤其对生产工艺中特有的高风险 HCP 因子,展现出更优的检出效果,为药物的安全有效和质量可控提供有力保障。
疫苗产品用宿主细胞蛋白(HCP)残留检测抗体覆盖率验证湖州申科 HCP检测试剂盒校准品经质谱和二维电泳双重表征,蛋白覆盖较广。
全球快速增长的抗体、蛋白类药物等生物药由相应工程细胞生产。生物制品药物生产过程中的宿主内源性蛋白,被称为宿主细胞蛋白(Host Cell Proteins, HCPs)会随着不同工艺流程部分残留在药物中。宿主细胞残留蛋白作为外源蛋白可能会在不同程度上引发机体的免疫应答,导致过敏反应或其它不良反应;另外还有一些残留HCPs具有蛋白酶或脂酶的活性,可能导致蛋白药物或辅料的降解,进而增加药物产品的质量和疗效的不稳定性。基于此,对药物中HCPs的定性与定量检测就显得尤为重要。全球各国药典如美国药典,欧洲药典以及中国药典都对HCPs检测提出了具体要求和标准。
LC-MS技术作为生物制品宿主细胞蛋白残留检测新趋势,需考虑以下几点:①稳定性:需要HCPs LC-MS检测流程进行验证,全流程都需要有严格的QC控制,确保检测结果的一致性和稳定性。②可重复性:不同类型生物制品中HCPs提取效率不同,不同人员操作存在差异,需要在上机前通过不同方法评估HCPs的提取效率,避免人为因素造成结果重复性差。③准确度:方法开发与验证阶段,通过设立内标与定量算法,根据内标响应回算得到HCPs的含量,确保定量结果的准确性。④抗干扰能力:高丰度蛋白和特殊基质会对质谱检测产生影响,需要通过前处理手段对高丰度蛋白或特殊的基质进行去除,以减少其对HCPs肽段在质谱检测时的影响。⑤真实性:样品中除HCPs以外的物质在质谱分析中同样会产生质谱信号,需要去除复杂的背景噪音避免假阳性和假阴性的出现,建立合理标准的生信分析流程。分析流程建立过程中同样需要建立严格的质控QC标准,并通过后期不同方法进行验证,确定其标准的真实性。
湖州申科HCP试剂盒开发经抗原表征、抗体制备到体系验证,全流程符合法规要求。
影响宿主细胞蛋白(HCP)残留检测结果的因素之一是操作规范。一方面,实验人员的专业技能和经验对检测结果的准确性有很大影响。熟练的实验人员能够准确地进行样品处理、试剂配制和仪器操作,减少人为误差。另一方面,一个合理的HCP检测方法,在开发及应用时,应当考虑操作的合理变动区间(即耐用性)并设置相质控,从程序上尽量消除人为误差对结果的影响。此外,严格遵循标准操作流程(SOP)是确保检测结果可靠性的关键。操作步骤的不规范可能导致结果的重复性差或误差增大。目前,湖州申科已正式推出全自动化HCP ELISA检测系统,可以完成从样品制备、孵育、洗板至数据采集等一系列操作,结合实验室信息管理系统(LIMS),可以实现“输入即输出”,减少流程误差。
宿主检测方法替换需桥接验证,确保新旧方法结果一致性与可比性。浙江ELISA法宿主细胞蛋白(HCP)残留检测方法学验证筛选HCP试剂盒需考虑线性稀释(一步法尤重)抗基质干扰稳定检测值、批间一致性、工艺匹配性等因素。江苏细胞基因治疗产品用宿主细胞蛋白(HCP)残留检测
湖州申科生物推出的宿主细胞残留蛋白检测全自动 ELISA 分析系统,整合了标曲制备、样本加样、恒温孵育、板孔清洗及结果检测等全流程功能。系统搭载的高精度前处理模块与检测模块,通准确控制实验参数,有效减少人为操作误差,确保实验结果的稳定性与准确性。其多模块单独运行设计,可实现不同检测任务的并行处理,大幅缩短实验周期,明显提升整体实验效率。在保障结果可靠的基础上,该系统实现了 ELISA 实验的自动化操作、标准化流程与快速化输出,降低了对实验人员的技能要求,同时通过优化资源配置减少检测成本。此外,系统内置完善的数据管理功能,可满足实验数据完整性记录与全流程审计追踪需求,严格符合 21 CFR Part 11 法规要求,并配备三级权限管理机制,进一步保障实验数据的安全性与规范性。
江苏细胞基因治疗产品用宿主细胞蛋白(HCP)残留检测