商机详情 -
抗体药物内毒素检测操作步骤
来源:
发布时间:2025年10月10日
生物制品(如单抗、疫苗、重组蛋白)注射剂因直接进入人体,对细菌内毒素残留限值要求严苛(通常≤0.5 EU/mg 或更低),检测面临基质复杂、干扰物质多等挑战。样品中常见的蛋白质、螯合剂、表面活性剂等可能抑制或增强 LAL 反应,需通过预处理消除干扰:如采用稀释法降低基质浓度、添加中和剂(如 Mg²⁺)修复反应体系,或使用热灭活去除蛋白类干扰物。此外,生物制品生产全流程需进行内毒素监控,从细胞培养上清、纯化中间品到终产品均需检测,确保工艺去除内毒素的有效性,符合 ICH Q6B 等法规对 “关键质量属性” 的控制要求。
绘制内毒素标准曲线时,起始浓度需统一为 1000EU/mL,避免稀释误差。抗体药物内毒素检测操作步骤
湖州申科针对 LER 提供多平台内毒素检测解决方案,适配不同成因的 LER 问题:一是鲎试剂配套增强剂,通过添加分散剂、过量二价阳离子,改善 LPS 聚集体状态,提升回收率;二是重组鲎试剂(rCR),无 G 因子干扰,完全模拟天然鲎级联反应,灵敏度达 0.005EU/mL,易与天然方法桥接;三是重组 C 因子(rFC),灵敏度 0.005-5EU/mL,性状稳定,适配特定基质;四是 单核细胞活化反应测定(MAT)法,通过检测 IL-6 覆盖全热原,不受 LPS 结构变化影响;五是质谱技术,验证基质残留对检测的干扰。多平台协同确保内毒素检测准确可靠。
重组蛋白内毒素检测法规要求重组级联试剂(rCR)适用于细胞培养辅料、单抗、冻干疫苗等样本,内毒素检测适用范围广。
内毒素检测中,样品中的蛋白质或酶的修饰作用易破坏鲎试剂的反应体系,导致检测结果失真。鲎试剂检测内毒素的本质是一系列丝氨酸蛋白酶的酶促放大过程,若样品中存在氧化剂、抗氧化剂、蛋白水解剂或专一失活剂,会直接灭活反应所需的酶;而乙醇、苯酚等物质则会导致蛋白质变性,同样抑制反应进程。例如,某些生物制品中含有的蛋白水解酶,可能提前降解鲎试剂中的蛋白酶,使内毒素无法被正常检测。为消除这类干扰,需优先限制样品中抑制物的含量:可采用内毒素检查用水稀释样品,降低抑制物浓度;对耐热的抑制物(如部分蛋白水解酶),可通过加热灭活处理(如 56℃孵育 30 分钟)破坏其活性;若样品基质复杂,还可使用超滤技术分离内毒素与干扰蛋白质,避免修饰作用对酶促反应的影响,保障内毒素检测结果的可靠性。
检测细菌内毒素的堂试剂方法,是一个生物反应过程,受到很多因素的干扰。在一个供试品的检测方法固定下来之前,为了得到准确的结果,必须要了解供试品与鲎试剂之间的相互关系。供试品中的成分往往非常复杂,而且会干扰试验检测系统的功能。很多干扰的机理,并不是非常清楚。但是业界比较能够接受的理论是,如果供试品中某些因子影响了鲎试剂中蛋白的表达功能,则被认为是干扰作用(Inhibition/Enhancement,V/E)。干扰作用产生的因素较多,一般包括试剂因素(鲎试剂、内毒素标准品)供试品因素(pH值、温度、离子强度、浓度、水溶性、黏度、可发生鲎试剂反应的非内毒素杂质)和实验因素(试验器皿、细菌内毒素检查用水、鲎试剂抗干扰能力)等。
重组级联试剂(rCR)无动物源,不含 G 因子,可避免 β- 葡聚糖致内毒素检测假阳性。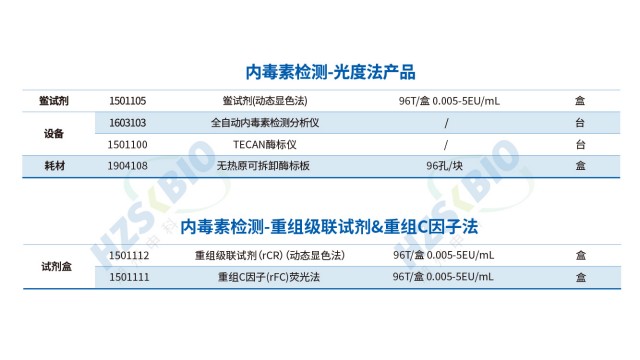
内毒素检测常与热原检测混淆,二者既有关联又有区别:热原是指所有能引起发热的物质(包括内毒素、病毒、真菌等),通过传统家兔热原试验检测;内毒素是热原的主要成分(占 90% 以上),检测更具特异性。目前,家兔热原试验因操作复杂、动物成本高,已逐渐被单核细胞活化反应测定法(MAT)替代,但部分产品(如放射性质药物、血液制品)仍需保留家兔试验作为补充。法规要求内毒素检测结果需与热原风险关联,若内毒素检测合格但临床出现热原反应,需排查是否存在非内毒素类热原,通过联合检测确保产品安全性。
70% 葡萄糖等高渗溶液会使鲎试剂蛋白变性,检测前需用检查用水稀释样本。浙江原料药内毒素检测风险评估细菌内毒素工作品若效价误差或不稳定,将影响实验结果。抗体药物内毒素检测操作步骤
当实验室更换内毒素检测方法或更换试剂供应商时,需进行方法比对与桥接验证。比对实验需选取至少 3批代表性样品,分别用新旧方法检测,计算结果相关性(如相关系数 R²≥0.95)和偏差(≤20%)。桥接验证还需评估新方法的特异性、灵敏度是否与旧方法一致,如确认对高风险样品(如含 β- 葡聚糖的样品)的抗干扰能力相当。若方法变更涉及法规申报产品,需将验证数据纳入申报资料,证明变更后方法仍能有效控制内毒素风险,符合 FDA、NMPA 等监管机构对方法变更的合规性要求。
抗体药物内毒素检测操作步骤
上一篇:
浙江CHO宿主细胞残留DNA检测常见问题
下一篇:
Vero宿主细胞残留DNA检测常用知识