商机详情 -
湖北免疫细胞产品支原体检测方法学验证
来源:
发布时间:2025年11月13日
湖州申科外源因子全自动核酸检测分析系统打造了 “样本进、结果出” 的高效检测流程,彻底简化支原体检测操作。检测只需一步式加样,最大支持 1mL 样本直接上样,无需复杂前处理,加样后系统自动完成核酸提取与检测,全程 3 小时内即可获取结果,其中样本准备时间不足 5 分钟,检测流程只需 2.5 小时。相比传统方法水浴消化、磁珠分离、洗脱等繁琐步骤,该系统操作极大简化,且配备 UI 触屏控制系统,内置标准化程序,支持扫码启动检测,无需专业 qPCR 操作培训,普通人员经简单指导即可上手。系统采用 4 通道单独运行设计,可同步开展不同样本检测,仪器还支持叠加延展通道,进一步提升检测产能,适配生物药多批次检测需求。
EP 新规明确支原体验证菌株 GC/CFU 比值<10,需在指数阶段收获以保障活性与分散性。湖北免疫细胞产品支原体检测方法学验证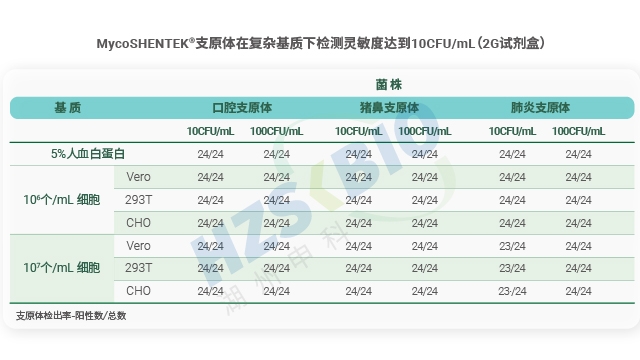
湖州申科构建了具有完备资质的支原体技术服务平台,为企业提供多元化支持。平台拥有 BSL-2/P2 微生物实验室备案资质,遵循 GMP-like 质量体系,具备支原体培养法、指示细胞法与 qPCR 法的检测及验证能力,配备符合药典要求的支原体标准菌株库与高灵敏度培养基(含液体、固体、半流体)。企业已通过 ISO13485:2016 质量管理体系认证(证书号 MD 709873),检测中心获得 CNAS 认证(注册号 CNAS L21942),符合 ISO/IEC 17025:2017 标准,具备国际互认资质。平台可提供多元化技术服务,包括支原体 qPCR 法检测能力建立、实验员能力考核、质量体系与流程搭建、实验室设计方案优化,以及样品检测(三种方法)、样品适用性验证、方法学验证、传统法与 qPCR 法比对、特殊菌株定制生产等,申报阶段可配合客户与监管机构完成现场审计。
吉林疫苗产品支原体检测国产替代高浓度质粒样品在进行支原体检测时,需通过浓缩离心预处理,提升支原体检出率。
MycoSHENTEK® 支原体 DNA 检测试剂盒参照 EP 2.6.7 和 JP XVII 支原体检测相关要求完成全面性能验证,是经过三方室间验证、性能完全符合药典标准的支原体检测试剂盒。该试剂盒检测灵敏度高达 10CFU/mL,可同时替代传统培养法与指示细胞培养法,大幅缩短检测周期。经实验验证,其对鸡滑液支原体、猪鼻支原体、莱氏无胆甾支原体等多种常见污染菌株的检出率均达到 100%(24/24),即使对口腔支原体等低浓度菌株,检出率也满足 95% 以上。凭借覆盖范围广、灵敏度高、性能稳定、合规性强的关键优势,该试剂盒为生物制品企业提供了高效、可靠的支原体检测工具,助力企业满足全球监管要求并保障产品质量。
质控结果是支原体 NAT 检测可靠性的前提,需严格遵循判定标准,且需结合实验室实际条件验证适配的标准阈值。质控样品的判定规则明确:NTC(无模板对照)的 FAM 信号需 2 复孔 Ct≥40 或无明显扩增曲线,VIC 信号需 2 复孔 Ct<35 且呈有效 “S” 型扩增;NCS(阴性对照)判定标准与 NTC 一致;PC(阳性质控)的 FAM 信号需 2 复孔 Ct<35 且呈有效 “S” 型扩增,PCS(阳性对照底物)判定标准与 PC 一致。只有质控结果全部满足要求,才能进一步分析样本结果,若质控不达标,需排查设备、试剂、操作等环节的问题并重新检测。
湖州申科提供支原体检测 qPCR 法方法学验证服务,含检测限、专属性、可比性等全维度验证。
支原体 NAT 检测的样本结果需结合 FAM 信号与 VIC 信号的表现综合判定,同时警惕抑制现象对结果的影响。若 FAM 信号 2 复孔有 1 孔以上 Ct<40 且呈有效 “S” 型扩增,VIC 信号 2 复孔 Ct<40 且呈有效 “S” 型扩增,判定为阳性;若 VIC 信号 2 复孔 Ct≥40 或无明显扩增曲线,则为阳性但存在抑制。若 FAM 信号 2 复孔 Ct≥40 或无明显扩增曲线,VIC 信号 2 复孔 Ct<40 且呈有效 “S” 型扩增,判定为阴性;若 VIC 信号同样 Ct≥40 或无明显扩增曲线,则阴阳性无法判断且存在抑制。出现抑制现象需重测,重测仍有抑制时,阳性倾向样本可适当稀释,阴性倾向样本需优化提取条件。
支原体检测中高浓度 DMSO 会抑制 PCR 反应,湖州申科通过优化样品预处理流程,有效消除该干扰。上海生物制品支原体检测培养法支原体兼具胞内胞外生存特性,检测需裂解细胞而非只取上清,避免漏检胞内污染。湖北免疫细胞产品支原体检测方法学验证
支原体 NAT 检测的特异性验证面临主要挑战:需设计覆盖多种支原体的 PCR 引物,而覆盖范围越广,越可能因支原体与革兰氏阳性菌的系统进化相关性,出现交叉检测现象,影响结果准确性。因此,特异性验证需重点排查非目标微生物的干扰,确保检测结果的专一性。稳健性验证同样关键,需证实检测方法在人为引入的微小参数变化(如反应温度、试剂浓度波动等)下,仍能保持结果稳定,避免因实验条件差异导致的检测偏差。这两项验证直接决定了 NAT 方法在不同实验室、不同操作场景下的适用性,是其获得法规认可的重要前提。
湖北免疫细胞产品支原体检测方法学验证
上一篇:
湖南疫苗产品支原体检测使用性验证