商机详情 -
吉林X射线-荧光X射线-荧光双模态成像系统哪个好
磁兼容设计:多模态影像的互补融合系统的模块化设计支持与MRI设备联动,先通过X射线-荧光双模态获取骨骼结构与分子标记数据,再用MRI补充软组织信息(如肿块周围水肿),形成“骨骼-肿块-微环境”的多元化评估。在脊柱肿块研究中,双模态与MRI的融合影像可同时显示椎骨破坏(X射线)、肿瘤细胞分布(荧光)及脊髓压迫程度(MRI),为手术方案设计提供三维立体参考,较单一模态的信息完整性提升60%。低剂量X射线扫描(<1mGy)与高灵敏度荧光检测结合,实现长期纵向的骨骼分子成像。该系统在骨质疏松研究中通过X射线量化骨密度,荧光标记成骨细胞活性动态。吉林X射线-荧光X射线-荧光双模态成像系统哪个好

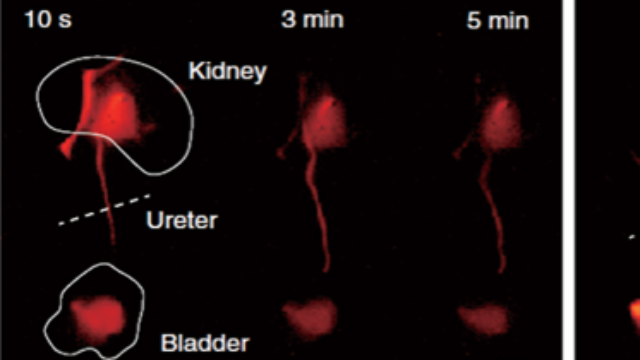
低剂量动态扫描:纵向研究的辐射安全方案针对需要长期观察的骨发育研究,系统采用“低剂量脉冲扫描”模式,单次X射线剂量<0.1mGy,配合高灵敏度荧光检测,可每周追踪小鼠骨骼生长板的变化(X射线量化软骨厚度)与生长因子表达(荧光标记IGF-1)。在侏儒症模型中,双模态成像显示生长板软骨厚度每周减少15μm,同时IGF-1荧光强度下降20%,这种无损动态监测为骨骼发育障碍的机制研究提供连续数据,避免传统处死取材导致的个体差异误差。 X射线—荧光双模态成像系统的剂量累积监控功能,自动优化扫描参数以降低动物辐射暴露。湖北X射线-荧光双模态成像系统价格对比高穿透X射线(50kV)与近红外荧光(1000-1700nm)的双模态组合,实现深层骨骼的分子成像。

骨微损伤的双模态量化:早期骨质疏松的预警指标系统通过高分辨X射线(2μm分辨率)识别骨小梁微裂纹(长度>50μm),配合荧光标记的骨细胞凋亡(AnnexinV探针),在骨质疏松模型中发现微裂纹区域的骨细胞凋亡率较正常区域高3倍,且X射线微裂纹数量与荧光凋亡信号的相关性达0.92。该技术可在骨密度下降前6个月检测到微损伤,为骨质疏松的早期预警提供结构-分子双重指标,较传统DXA检测提前发现风险。 X射线—荧光双模态成像系统的多参数分析模块,量化骨体积分数与荧光信号强度的相关性。
手术导航与术后评估:全流程诊疗支持双模态系统贯穿骨肿块诊疗全周期:术前通过X射线-荧光成像制定切除范围(如肿块边界外5mm),术中实时导航确保切缘阴性,术后通过双模态复查评估骨愈合(X射线骨痂密度)与肿瘤复发(荧光标记残留细胞)。在兔胫骨肿块模型中,该全流程方案使肿块局部控制率达90%,且术后6周的骨愈合评分(X射线骨密度+荧光血管密度)较传统手术提升40%,展现“诊断-医治-评估”的一体化优势。 磁兼容设计的双模态系统可与MRI设备联动,补充软组织信息与骨骼分子成像数据。兼容小动物与大动物模型的双模态系统,为骨疾病转化研究提供跨物种成像解决方案。
双模态数据的病理关联分析:影像与组织学的定量整合系统支持双模态影像与组织病理学数据的配准分析,在骨**研究中,将X射线的骨破坏区域、荧光的肿瘤细胞分布与病理切片的HE染色结果叠加,可量化影像指标与病理分级的一致性(如G3级**的荧光强度较G1级高3倍)。这种整合分析使影像诊断的准确率从75%提升至92%,并能发现传统病理难以量化的空间分布特征,如肿瘤细胞沿骨小梁间隙的浸润模式。 X射线—荧光双模态成像系统支持骨靶向纳米药物的分布评估,X射线定位骨骼,荧光追踪药物蓄积。X射线—荧光双模态成像系统的AI模型预测功能,基于双模态数据预测骨肿块的转移风险。中国香港荧光X射线-荧光双模态成像系统24小时服务
X射线—荧光双模态成像系统的多参数分析模块,量化骨体积分数与荧光信号强度的相关性。吉林X射线-荧光X射线-荧光双模态成像系统哪个好
双模态成像的未来技术升级:AI+多模态的智能融合系统预留AI算法接口与多模态扩展端口,未来可集成机器学习模型(如基于Transformer的骨疾病预测网络)与质谱成像(MALDI),实现“X射线结构-AI预测-荧光验证-质谱代谢”的四维分析。在概念验证实验中,AI模型基于双模态数据预测骨肿块的转移风险(AUC=0.95),并通过质谱成像验证预测区域的代谢异常(如脂质代谢通路打开),为骨骼疾病的精细医学研究开辟“影像-分子-代谢”的多维研究范式。吉林X射线-荧光X射线-荧光双模态成像系统哪个好