商机详情 -
江西X射线-荧光双模态成像系统量大从优
双模态光谱分析:骨骼成分与分子探针的同步检测系统的X射线荧光光谱(XRF)功能可分析骨矿物质成分(如Ca/P比),同时近红外荧光通道检测探针信号,在骨矿化障碍疾病中实现“成分-分子”联合分析。在佝偻病模型中,XRF显示骨Ca/P比从1.67降至1.42,荧光标记的维生素D受体表达下降35%,两者的相关性达0.89,为疾病机制研究提供化学组成与分子调控的双重证据,较单一检测手段更多元化揭示病理本质。双模态探头的模块化设计支持灵活切换X射线分辨率(5-50μm)与荧光检测灵敏度。低剂量X射线扫描(<1mGy)与高灵敏度荧光检测结合,实现长期纵向的骨骼分子成像。江西X射线-荧光双模态成像系统量大从优

术中放疗剂量引导:双模态影像的医治优化结合X射线的骨结构成像与荧光标记的放疗敏感器(如H2AX探针),系统在骨肿块术中放疗中实时评估剂量分布:X射线定位肿块边界,荧光监测放疗诱导的DNA损伤(荧光强度与剂量呈线性相关,R²=0.98)。该技术可避免传统放疗的剂量盲区,在犬骨肿块模型中使肿块局部控制率提升30%,同时通过荧光信号调控放疗剂量,将正常骨组织的辐射损伤降低50%,实现“精细放疗-保护正常组织”的双重目标。该系统在骨代谢疾病中通过X射线评估骨转换率,荧光标记代谢相关蛋白酶活性。辽宁X射线-荧光双模态成像系统采购信息自适应剂量调节的X射线模块与近红外二区荧光结合,降低辐射风险同时提升分子信号信噪比。
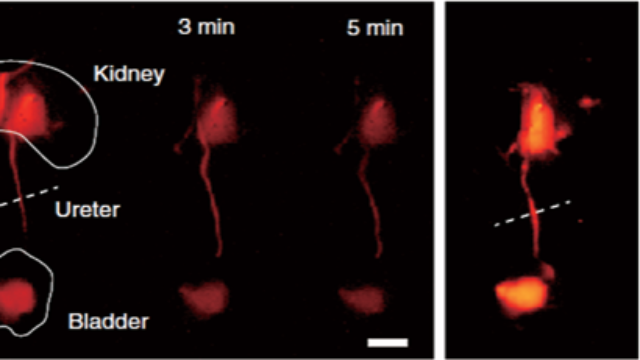
骨微损伤的双模态量化:早期骨质疏松的预警指标系统通过高分辨X射线(2μm分辨率)识别骨小梁微裂纹(长度>50μm),配合荧光标记的骨细胞凋亡(AnnexinV探针),在骨质疏松模型中发现微裂纹区域的骨细胞凋亡率较正常区域高3倍,且X射线微裂纹数量与荧光凋亡信号的相关性达0.92。该技术可在骨密度下降前6个月检测到微损伤,为骨质疏松的早期预警提供结构-分子双重指标,较传统DXA检测提前发现风险。 X射线—荧光双模态成像系统的多参数分析模块,量化骨体积分数与荧光信号强度的相关性。
双模态成像的未来技术升级:AI+多模态的智能融合系统预留AI算法接口与多模态扩展端口,未来可集成机器学习模型(如基于Transformer的骨疾病预测网络)与质谱成像(MALDI),实现“X射线结构-AI预测-荧光验证-质谱代谢”的四维分析。在概念验证实验中,AI模型基于双模态数据预测骨肿块的转移风险(AUC=0.95),并通过质谱成像验证预测区域的代谢异常(如脂质代谢通路打开),为骨骼疾病的精细医学研究开辟“影像-分子-代谢”的多维研究范式。X射线—荧光双模态成像系统支持术中实时导航,通过X射线定位骨肿块与荧光标记边界。

骨代谢动态监测:X射线与荧光的功能关联利用X射线的骨密度量化能力(误差<3%)与荧光标记的代谢酶活性(如ALP探针),系统在甲状旁腺功能亢进模型中观察到血钙升高时,骨吸收区域的荧光强度上升40%,同时X射线显示骨密度下降8%,两者的时间相关性达0.95。这种动态监测技术为骨代谢疾病的机制研究提供“血钙-酶活性-骨结构”的闭环证据,助力新型抗骨代谢药物的研发与疗效评估。 X射线—荧光双模态成像系统的AI模型预测功能,基于双模态数据预测骨肿块的转移风险。该系统在骨再生医学中通过X射线监测植入物骨整合,荧光标记干细胞分化轨迹。青海X射线-荧光双模态成像系统哪里买
X射线—荧光双模态成像系统的无线数据传输功能,支持手术间与实验室的实时影像共享。江西X射线-荧光双模态成像系统量大从优
双模态引导的显微取样:精细定位与机制验证在双模态成像指引下,可对X射线异常区域(如骨密度降低区)与荧光高表达区域进行显微取样,确保组织学分析的精细定位。在骨纤维异样增殖症模型中,双模态引导的取样使病理阳性率从传统随机取样的60%提升至95%,且能同步获取影像数据与分子检测结果,如X射线所示的磨玻璃样改变区域中,荧光标记的FGFR3突变细胞比例达80%,为疾病分子机制研究提供“影像-病理-基因”的闭环证据。高穿透X射线(50kV)与近红外荧光(1000-1700nm)的双模态组合,实现深层骨骼的分子成像。江西X射线-荧光双模态成像系统量大从优