商机详情 -
海南怎样科研技术服务公司
把培养瓶置于倒置显微镜下观察,如大部分细胞变圆,立即移除胰酶消化液(如大部分细胞漂起,可不移除胰酶消化液),加入5ml预热完全培养基,用吸管取培养液吹打瓶壁细胞,使其脱离瓶壁形成单细胞悬液,离心,小心移除上清;3、加入5ml预热完全培养基,吹打重悬细胞用细胞计数板在显微镜下计算细胞数,分装入T25培养瓶中,添加基至总体积为5ml,置于37℃、5%CO2培养箱中培养;传代1次。注意事项1.熟知所养细胞的生长密度极限;2.进行所养细胞传代时,消化时必须把培养瓶置于倒置显微镜下观察,并记录所需时间,下次按照该时间执行即可;3.进行细胞传代时必须结合考虑细胞生长密度需求(启动正常生长所需的密度)和实际的工作需求,在满足细胞生长密度需求的前提下,需要多少瓶就传多少瓶,降低工作强度和试剂耗材消耗;4.离心速度和时间依据具体细胞决定。四.细胞冻存保种1、提前配制冻存液:用血清或完全培养基配制5-10%DMSO(根据具体细胞决定)冻存液;2、消化收取细胞:当细胞密度即将达到其生长密度极限时进行换液,第二天,移除旧培养液,用PBS洗涤两次(旧培养中的钙离子会抑制胰酶的活性),加入1ml胰酶消化液(以T25培养瓶为例),立即盖好盖子。准确营养干预方案,基于个体遗传信息与代谢特征,设计个性化饮食建议,预防慢性病。海南怎样科研技术服务公司
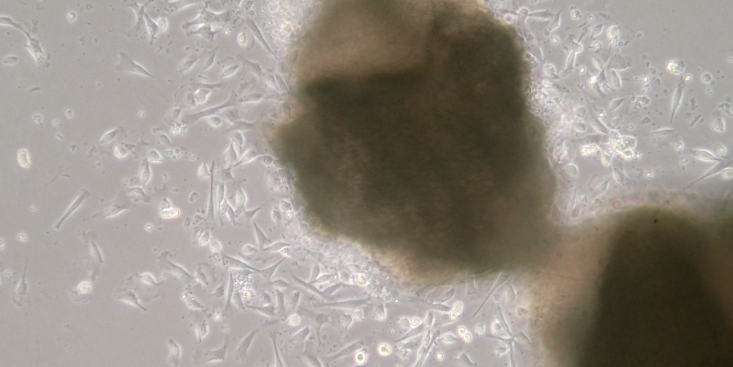
并进行无内质粒抽提。GAG质粒和VSV质粒同样可以转化至感受态细菌DH5α中,并进行无内质粒抽提。质粒抽提后冷冻于-20℃保存。2、慢病毒包装1)使用DMEM完全培养基培养6cm皿HEK293T至汇合度为70~80%。采用opti-MEM和Lipo3000分别转染含有目的基因的pMSCV-eGFP、VSV、GAG质粒及对照载体,每皿加入脂质体-质粒转染混悬液按购买脂质体相关说明书操作定量。继续培养24h。2)24小时后,将培养基更换为新鲜的DMEM完全培养基,放进细胞培养箱继续培养48~72h。3)48~72h后收集上层培养液,并过μm滤膜,采用ELISA法对所获得的慢病毒载体进行病毒滴度测定。如不及时使用可以冻存于-80℃。3、慢病毒转染1)转染前1天将细胞接种6孔培养板,时细胞的融合率约为50%,前需换液,加入1mLDMEM完全培养基。2)病毒冰浴融化后加入相应体积的病毒液及聚凝胺(Polybrene),混匀后放入37℃孵箱中继续培养3)4h后补充1mL培养基,14h后换液(24h内换液即可)。4)病毒72h后用倒置显微镜观察荧光,监测效率,出现较多荧光时将等量的转染细胞和未转染细胞分别加入等浓度Puromycin(Puromycin或其他筛选浓度需要事先摸索)。5)待未转染细胞全部死亡并且可观察到满意荧光量时,降低Puromycin浓度培养。专业科研技术服务设计基因组关联分析,挖掘遗传变异与复杂疾病之间的关系,为准确预防与疗愈策略提供科学依据。
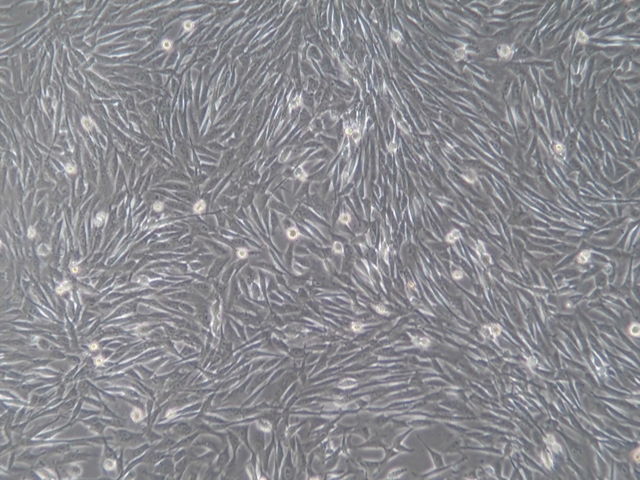
也可以挑去单克隆细胞株进行进一步培养,以得到满意的稳定表达目的基因的细胞株。6)使用qRT-PCR和Westernblot的方法检测目的基因的表达量和蛋白水平是否显著提高。7)由此可得三组细胞株:a.正常细胞株;b.空载病毒载体的细胞株;c.过表达目的基因的病毒载体的细胞。8)在后续培养传代该稳转细胞株时,培养基中需添加低浓度Puromycin做压力筛选条件。注意事项1.为避免慢病毒后细胞死亡,务必保证原始细胞无支原体污染。2.查阅压力筛选条件在目标细胞系中稳转株筛选的致死用量信息。3.查阅文献确定慢病毒在目标细胞系中的滴度。4.转染后可以进一步进行单克隆稳转株培养,可采用稀释法和培养皿挑取法。5.慢病毒转染载体种类繁多,应选择适合目的细胞系的载体进行病毒的包装和转染。常见问题转染时病毒滴度较低可以将6cm皿培养的HEK293T更换为10cm皿培养,或使用超速离心沉淀法或PEG-8000浓缩法提高病毒滴度。
的鉴定指标,如人脐静脉内皮细胞HUVECs,如分子指标为vWF和CD34阳性以及αSMA和CD45阴性,功能指标包括血管形成能力、内吞能力等,我司都具有检测能力。其他类型细胞比如平滑肌细胞一般为α-SMA阳性、Vimentin阴性,成纤维细胞则与之相反。因此我司可以为每个细胞进行相应的费用优惠的检测服务,比如细胞的一阴一阳只需要1500元,并无需客户提供抗体。2、由于原代细胞的多样性,我司所提供的原代细胞种类并不局限于上表,我们可以根据客户的需求进行原代细胞的定制服务。3、鉴于我司长期致力于构建原代细胞库,我司具有各种特定原代细胞的优化的分离体系与培养体系,因此可以提供各种原代细胞相应的分离、鉴定与培养成套产品,人脐静脉内皮细胞HUVECs分离试剂盒、鉴定试剂盒与相应的培养液。基因疗愈技术,直接修正致病基因,为遗传性疾病患者提供潜在的疗愈途径。

1.分子杂交与印迹技术(1)探针是经过特殊标记,能与待测单链核酸分子互补结合的已知核酸片段(2)印迹是将电泳分离后的大分子转印到硝酸纤维素膜上,以便杂交的技术(3)DNA印迹:Southernblotting,用于检测基因组DNA(4)RNA印迹:Northernblotting,主要用来检测mRNA的表达水平(5)蛋白质印迹:Westernblotting,用于检测蛋白质的水平(1)反应体系:单链DNA模板、特异性DNA引物、耐热DNA聚合酶(TaqDNA聚合酶)、dNTPs底物、含Mg2+的缓冲液。(2)反应步骤:变性、复性、延伸(3)逆转录PCR:即RT-PCR,在PCR之前先将单链mRNA逆转录成cDNA。这是目前从RNA水平出发研究基因表达或获得目的基因的方法。(4)应用:目的基因的克隆、基因的体外突变、微量DNA或RNA扩增、DNA序列测定、基因突变分析3.蛋白质相互作用研究酵母双杂交技术、(EMSA)、染色质免疫沉淀技术(ChIP)5.基因敲除即geneknock-out,通过同源基因重组原理使得某个基因活性丧失。遗传咨询与基因检测服务,为个体提供遗传病风险评估、携带者筛查等,指导优生优育与个性化健康管理。吉林怎样科研技术服务优化
传染性疾病诊断技术,开发针对新发、突发传染病的快速诊断试剂,助力防控。海南怎样科研技术服务公司
血管生长是发生的关键步骤。无论原发性还是继发性,一旦生长直径超过1~2mm,都会有血管生成,这是由于细胞自身可分泌多种生长因子,诱导血管生成。由于组织这种新生血管结构及功能异常,且血管基质不完善,这种微血管容易发生渗漏,因此细胞不需经过复杂的侵袭过程而直接穿透到血管内进入血流并在远隔部位形成转移。越来越多的研究表明,良性血管生成稀少,血管生长缓慢;而大多数恶性的血管生成密集且生长迅速,因此,血管生成在的发展转移过程中起到重要作用,抑制这一过程将能明显阻止组织的发展和扩散转移。血管生成实验的技术原理主要是应用Matrigel模拟机体环境,上面接种细胞,观察血管生成情况。体外的血管生成实验能很好的模拟的血管发生过程,并且适合研究药物对这一过程的影响实验。我们以HUVEC细胞为例,介绍这一实验的详细过程。1、主要步骤Step1:细胞培养Step2:细胞转染或药物处理Step3:铺Matrigel胶Step4:接种细胞Step5:观察血管生成情况实验过程中需要注意:1、实验前一天需要将Matrigel置于冰盒,放入冰箱中,同时需要准备一些预冷的头用于吸取Matrigel胶;2、将Matrigel胶加到血管生成载玻片时注意头要垂直于内孔的正上方加入Matrigel。海南怎样科研技术服务公司