商机详情 -
江苏原料药eCTD品牌
危机应对与应急递交机制 在公共卫生紧急事件(如COVID-19)中,EMA允许简化eCTD序列,优先审评关键模块并暂缓非数据。申请人可通过快速通道(Fast Track)提交疫苗或药物的eCTD资料,审评周期可压缩至6个月。此类申请需附风险评估报告,并承诺后续补交完整数据。 数据安全与长期存档 欧盟要求eCTD资料存档期限至少为药品上市后30年,EMA采用分布式存储和区块链技术确保数据不可篡改。申请人需定期备份本地副本,并使用符合GDPR要求的加密传输协议(如AS2)递交。历史数据的迁移和格式转换(如NeeS转eCTD)需遵循特定技术规范。 环保效益与可持续发展 eCTD取代纸质递交后,欧盟每年减少约500吨纸张消耗,审评流程的数字化降低碳足迹约30%。虚拟审评会议和电子签名进一步减少了差旅需求,契合欧盟2050碳中和目标。未来,eCTD4.0将通过数据压缩技术进一步降低服务器能耗。中DMF注册申报相关技术支持。江苏原料药eCTD品牌

ANDA递交: 按照ICH M4的CTD格式整理资料,并以eCTD格式递交; 通过ESG通道递交资料; 收到CDER的letter,说明资料已经进入FDA数据库; 付GDUFA费,在资料递交后的10日内到账; ANDA接收: 缴费后,FDA初步审查资料的完整性,并会在60天给答复。 第一种情况是ANDA无缺陷,FDA给申请人发受理信(Acceptance Letter); 第二种情况是ANDA包含少于10个小缺陷,FDA将会通过电话、传真、电子邮件等方式通知发布IR (信息请求函),让申请人在7个日历日内改正,若未按时补充所有需要的资料,FDA将拒收该ANDA; 第三种情况是ANDA包含1个或者多个重大缺陷,或10个以上的小缺陷,FDA将拒收该ANDA; 注:如果这边被拒收,只退75%的费用。苏州药品注册eCTD服务介绍美国eCTD验证标准相关技术支持。
设施费动态调整 API工厂和制剂工厂年费分别约6.8万和14.5万美元(2025财年),CMO工厂费用为制剂费的24%。国外工厂需额外支付1.5万美元跨境检查费。 缴费时限与惩罚 费用需在财年首日(10月1日)起20天内缴纳,逾期将列入拖欠名单并暂停ANDA受理,涉事药品视为冒牌产品。 豁免与特殊情形 PET药物、非商业产品及停产超一年的工厂可豁免缴费。已缴费工厂若年度内无生产活动,仍需缴纳费用。 行业影响与策略 费用上涨推动企业优化申报策略,例如集中ANDA提交周期、采用CMO外包降低设施费,并通过预认证(如DMF完整性评估)减少重复支出。
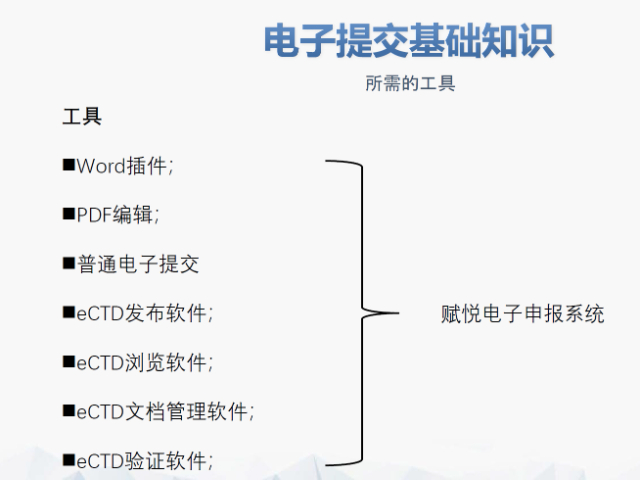
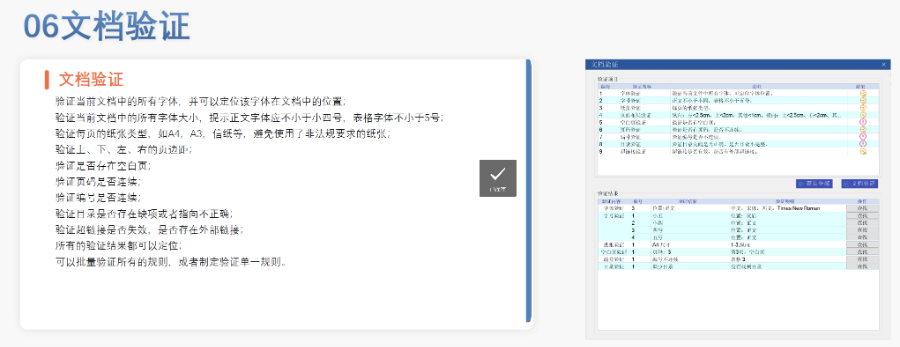
赋悦Word插件 自主研发Word插件 快速编辑:整合word常用功能按钮,避免频繁切换菜单;内置标题、段落、文字、目录、超链接等的格式和样式,可快速设置和更文档的格式 快速链接:双击或者拖拽的方式,制作文本超链接或者题注超链接;可搜索全文关键字,自动制作超链接 文档拆分:可根据不同的条件将word文件颗粒化,如分节符、页眉、页脚、页码范围和自定义页码等 PDF转换:WORD转PDF,自动判断是否生成书签,自动镶嵌所有字体,生成PDF快速网页浏览的PDF,确保生成的PDF所有属性符合法规要求 文档验证:验证文档的字体、字号、纸张、页面布局、空白页、页码、编号、目录、超链接等,并且可以定位验证结果 可定制:可根据用户需求定制格式和样式模板美国ESG电子提交通道申请相关技术支持。
仿制药作为提高药物可及性与可负担性的一类药物,2012年以前,注册审评是不收取任何费用的,但当时仿制药申请积压严重,从申报到获批需要3~5年的时间。 美国国会于2012年颁布了仿制药使用者费用修正案(Generic Drug User Fee Amendments, GDUFA),该法律要求制药行业支付一定的用户费用,以补充仿制药申请的审评以及现场检查的费用,减少仿制药申请积压,缩短审评时间,增加基于风险的现场检查等,其目的是加快公众获得安全有效的仿制药,并降低行业成本。 GDUFA必须每五年重授权一次,于2017年更(GDUFA II),于2022年更(GDUFA III); 目前收费种类分为以下四种:ANDA审评费、DMF审评费,在审评时一次性缴纳;项目费(Program fee)、设施费(Facility fee),是上市后每年缴纳一次。美国eCTD注册外包相关技术支持。河北eCTD常用解决方案
eCTD验证实践手册相关技术支持。江苏原料药eCTD品牌
电子签章与传输安全 文件需经AES-256加密后刻录至不可擦写光盘,并附MD5校验码。光盘损坏或病毒污染将触发重递交流程,原载体按销毁程序处理。 审评与核查协同 自2018年起,FDA要求提交两套光盘分别用于审评和现场核查,2022年调整为“1套审评+1套核查+1套专项资料”模式,提升流程效率。 国际化兼容性增强 美国eCTD系统支持与欧盟、日本等地区的XML互操作性,但区域差异(如模块1的标签要求)仍需人工适配。 未来通道创 FDA计划引入API接口支持企业系统直连,并探索基于云存储的实时提交与审评,减少物理媒介依赖。江苏原料药eCTD品牌