商机详情 -
CHO细胞蛋白表达
从裂解物来源看,无细胞蛋白表达技术主要分为原核系统和真核系统。原核系统以大肠杆菌S30提取物为主,成本低、耐受性强,适合表达简单蛋白或引入非天然氨基酸,但缺乏复杂翻译后修饰能力。真核系统包括兔网织红细胞裂解物(RRL)和麦胚提取物(WGE),前者适合哺乳动物蛋白的高效表达,后者对植物和病毒蛋白更优,且能处理长链RNA,但成本较高。此外,昆虫细胞提取物系统近年也用于复杂蛋白的修饰研究。英国nuclera 高通量微流控蛋白表达筛选系统可助力支持无细胞蛋白表达技术,如想了解更多信息,欢迎咨询官方代理商上海曼博生物!CHO细胞重组蛋白表达是生产抗体的常用技术。CHO细胞蛋白表达

无细胞蛋白表达技术在实际应用中也存在一些技术短板。由于反应体系缺乏活细胞的代谢调控机制,能量供应和原料再生效率较低,导致反应持续时间较短(通常只维持4-6小时),限制了蛋白产量的进一步提升。同时,该技术对反应环境高度敏感,温度波动、氧化应激或污染物都可能影响蛋白合成效率,这对实验操作的稳定性提出了更高要求。此外,虽然CFPS能表达传统细胞系统难以生产的毒性蛋白,但对于需要复杂折叠或多亚基组装的蛋白(如某些膜蛋白或超大分子复合物),其成功率仍然有限。酵母蛋白表达protocol芯片级体外蛋白表达平台在个性化医疗中尤为关键,能够帮助指导靶向药物选择。

无细胞蛋白表达技术(CFPS)正在彻底改变合成生物学、生物技术和药物开发等关键领域,它通过突破传统大肠杆菌(E. coli)等细胞表达系统的固有局限,实现了三大he xin优势:更快的生产周期更灵活的合成条件调控;可表达毒性蛋白或体内难以合成的复杂结构蛋白;这使得CFPS成为zhi liao性蛋白开发、功能基因组学和高通量蛋白质筛选不可或缺的工具。由于摆脱了细胞代谢的束缚,CFPS可实时优化反应条件,从而明显提升蛋白产量并优化生产效率。
体外蛋白表达技术的重点在于利用细胞裂解物中的生物合成机器(核糖体、tRNA、翻译因子)在试管中直接合成蛋白质。以大肠杆菌系统为例:首先制备含T7启动子的线性DNA模板,将其与商业化裂解物(如RocheRTS100)、能量混合物(ATP/GTP)及20种氨基酸混合,在37℃振荡反应2-4小时即可完成蛋白表达。整个过程无需细胞培养与基因转染,速度比传统方法快10倍以上。例如,COVID19刺突蛋白RBD结构域的体外表达只需6小时,而HEK293细胞系统需5天。该技术的关键优势是开放体系的可编程性——可直接添加非天然氨基酸(如Azidohomoalanine)合成定制化蛋白,为药物偶联物开发提供高效平台。通过灌流式反应器将CHO细胞体外蛋白表达周期缩短至72小时,单批次产量突破5g/L。
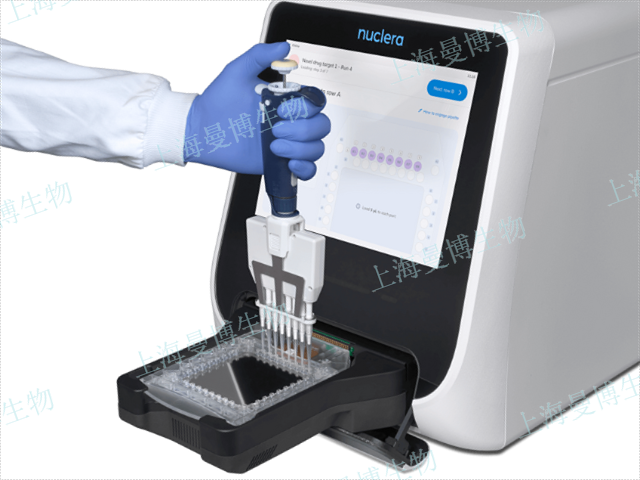
无细胞蛋白表达的兴起可将这一时间缩短至十几个小时,但是仍需要现进行表达载体的制备,体外扩增和高通量蛋白表达然后再进行筛选等多步操作。Nuclera将这些复杂的流程ji he到eProteinDiscovery系统。该系统使用基于数字微流控的智能卡盒、蛋白质质量检测和无细胞蛋白合成,使研究人员更容易快速获取高质量蛋白质。只要将目标蛋白质的序列输入配套软件,就可以利用预设融合标签定制DNA构建体以优化表达,然后将表达载体装载到机器上,该系统就会通过自动化构建筛选(可同时筛24种DNA构建体x8种无细胞混合物=192种独特表达条件),根据可溶性、可纯化性和纯化产量数据确定Zui 佳表达条件,然后放大规模并获取蛋白质以供下游应用,从DNA到可用于分析检测的蛋白质只需要48小时。系统已生产超过2,000种蛋白质,包含多种类型,其中约77%的人类蛋白。蛋白质类型包括伴侣蛋白、水解酶、连接酶、氧化还原酶、信号蛋白、结构蛋白和转移酶等,分子量范围为18kDa~300kDa(平均:46kDa)。获得的难表达蛋白包括膜蛋白、含二硫键的蛋白和含高度无序结构的蛋白等,还更容易地筛选和获取同源物、直系同源物、突变和异构体。体外蛋白表达技术使致死性靶点研究成为可能,为新药开发提供关键依据。酵母蛋白表达protocol
小麦胚芽裂解物则凭借低核酸酶活性成为长期反应(>24小时)的理想选择。CHO细胞蛋白表达
提升体外蛋白表达效能的关键技术路径包括:裂解物工程化改造: CRISPR敲除核酸酶/蛋白酶基因增强稳定性,或过表达分子伴侣(如GroEL/ES)改善折叠;能量再生系统强化: 耦合葡萄糖脱氢酶与ATP合成酶模块,实现ATP持续再生;膜蛋白表达突破: 添加脂质纳米盘(Nanodiscs)提供类膜环境,促进跨膜结构域正确折叠;高通量筛选适配: 微流控芯片实现万级反应并行运行,单次筛选规模超越传统细胞方法。这些策略共同推动该技术向 更高效率、更低成本、更广适用性演进。CHO细胞蛋白表达