商机详情 -
天津纤维化原代细胞分离培养价格
并进质粒抽提。GAG质粒和VSV质粒同样可以转化至感受态细菌DH5α中,并进行无内质粒抽提。质粒抽提后冷冻于-20℃保存。2、慢病毒包装1)使用DMEM完全培养基培养6cm皿HEK293T至汇合度为70~80%。采用opti-MEM和Lipo3000分别转染含有目的基因的pMSCV-eGFP、VSV、GAG质粒及对照载体,每皿加入脂质体-质粒转染混悬液按购买脂质体相关说明书操作定量。继续培养24h。2)24小时后,将培养基更换为新鲜的DMEM完全培养基,放进细胞培养箱继续培养48~72h。3)48~72h后收集上层培养液,并过μm滤膜,采用ELISA法对所获得的慢病毒载体进行病毒滴度测定。如不及时使用可以冻存于-80℃。3、慢病毒转染1)转染前1天将细胞接种6孔培养板,时细胞的融合率约为50%,前需换液,加入1mLDMEM完全培养基。2)病毒冰浴融化后加入相应体积的病毒液及聚凝胺(Polybrene),混匀后放入37℃孵箱中继续培养3)4h后补充1mL培养基,14h后换液(24h内换液即可)。4)病毒72h后用倒置显微镜观察荧光,监测效率,出现较多荧光时将等量的转染细胞和未转染细胞分别加入等浓度Puromycin(Puromycin或其他筛选浓度需要事先摸索)。5)待未转染细胞全部死亡并且可观察到满意荧光量时,降低Puromycin浓度培养。专业做原代细胞分离的公司。天津纤维化原代细胞分离培养价格
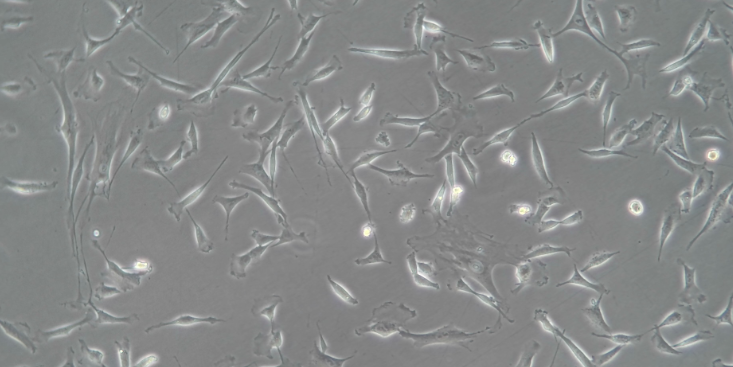
1、取新鲜抗凝全血(EDTA、枸橼酸钠或肝素抗凝血均可)或者去纤维蛋白血液,用等体积的全血及组织稀释液或者PBS稀释全血。2、取一支无菌离心管,先加入试剂A,再加入试剂D,使两者形成梯度界面(试剂A:试剂D的体积比为3:2,如稀释后的血液样本小于5ml,则先后加入3ml试剂A和2ml试剂D;如稀释后的血液样本大于5ml,试剂总量与稀释后的血液样本量相等),两种试剂的分层一定要清晰。3、将稀释后的血液平铺到分离液液面上方,注意保持两液面界面清晰。(可以使用巴氏德吸管吸取血液,然后将血液小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。如果样品较多,加样的时间较长,在离心之前出现红细胞成团下沉属正常现象)4、室温,水平转子500~800g,离心20~30min(血液的体积越大所需的离心力越大,离心时间越长,的分离条件需自行摸索,离心转速不超过1000g)。5、离心后将出现明显的分层:层为血浆层;第二层为白色单核细胞层;第三层为透明试剂D液层;第四层为半透明试剂A液层;第五层为红细胞层(如图示)。6、小心吸取第二层白色单核细胞层到另一无菌的15ml离心管中,加入10mL细胞洗涤液或PBS,颠倒混匀,250g,离心10min。7、弃上清。江苏哪家公司提供原代细胞分离培养购买肝脏星状细胞占肝脏固有细胞总数的15 %,占非实质细胞的30%左右。

建议按照2×106每孔的数量将293T细胞均匀铺入。(2)第二天:在24小时之内,观察293T细胞的汇合度在90%~95%之间时,向其中加入DNA-脂质体复合体,DNA-脂质体复合体制备方法如下:a)轻轻混匀LipoMax,根据说明书加入相应量于500µlOpti-MEM无血清培养基中,混合均匀并置于室温5分钟。b)在500µlOpti-MEM无血清培养基中稀释DNA,总质量为15µg按照载体质粒:psPAX2:=4:3:1的比例加入DNA。c)将稀释后的LipoMax和稀释后的DNA轻轻混匀,常温静置20分钟,形成DNA-LipoMax复合体。(3)将DNA-LipoMax复合体轻柔地滴加至细胞培养皿中,轻轻摇晃培养皿混匀,放入细胞培养箱中培养。(4)病毒收集浓缩病毒:加入DNA-LipoMax复合体48小时后,收集病毒上清,同时加入10ml预温的293T培养基到细胞培养皿中。将收集到的病毒上清存在4℃冰箱中;收集72小时病毒上清,与48小时病毒上清混在一起。将离心机温度降温到4℃,600g,离心5分钟,去除其中的细胞碎片,上清液经µm滤头过滤,加入病毒浓缩液,配制浓缩病毒液。将浓缩后的病毒放于4℃冰箱摇床上,旋转过夜。第二天,4度离心机,3000~4000g离心15分钟。弃掉上清液,加入1Xpbs或培养基重悬。
然后将感兴趣的药物通过电穿孔或脂质体转染等方法装入纯化的外泌体。外泌体内可装载的药物包括小分子化学药物、蛋白质和多肽、核酸药物、天然产物等。外泌体的抑制作用外泌体水平升高通常与不同类型的恶化相关,一些研究人员希望能通过降低外泌体到正常水平来防止不良预后。从这个角度出发,许多正在进行的研究旨在通过调节外泌体生成分泌的过程或通过特异性靶向其成分抑制其与靶细胞的相互作用来调节外泌体的产生。如今我们对外泌体机制和不同生理和病理条件下的功能的理解呈指数级增长,虽然目前其生物学功能还未完全解析清楚,但研究者们在许多领域均已对其进行了深入探索。外泌体不是废物颗粒,而是细胞间通讯的关键介质,作为宿主细胞的卫星,外泌体包含大量的生物信息,其功能超出了初的预期,宿主细胞控制着外泌体的内容物,从而改变了自己或其他细胞的命运。其次,外泌体对的进展和转移有着强烈的影响,可以通过外泌体预测转移的部位并建立转移前的生态位。参考文献:[1]高方园,焦丰龙,张养军,秦伟捷,钱小红.外泌体分离技术及其临床应用研究进展[J].色谱,2019,37。胃平滑肌细胞的主要作用是通过肌肉的收缩蠕动向胃内推进食物。
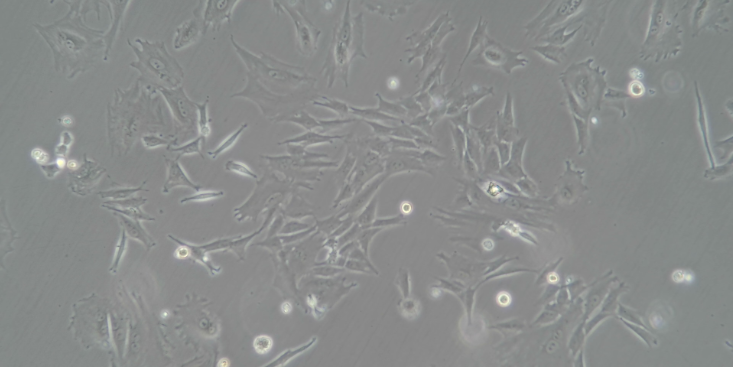
在温度37℃中培养24h左右,然后观察其形态,颜色等变化。除此之外,平行设置两个稀释度培养基,步骤是先稀释样本,通过稀释后,微生物可以分散为单个细胞,然后进行一定环境条件下培养,直到其长成菌落为止,然后进行计算大肠杆菌的数量,通过稀释度和样本数量进行计算。免疫磁珠法该分离技术的主要原理是以磁珠为载体和抗体,进行抗体和磁珠的结合,然后通过磁力技术完成力学的移动,进而分离大肠杆菌。与其他方式相比,这样的方式方法具有一定的优点,该技术可以提升样本中病原性弧菌的检测成功率,并且免疫磁珠技术可以于不同菌种中对不同的微生物进行处理,进而在很大程度上提高检测效率。自动化仪器检测法主要是运用免疫自动化分析仪,该技术产生并运用于1970年。随着科技的发展和进步,自动化仪器检测技术应用非常广,并且操作起来非常方便,可以节约很多时间,其受干扰的程度较小,可以节省人力物力的投入,也可以提高检测的精确度。在现阶段的发展过程中,自动酶的免疫检测体系的应用非常广。ATP生物发光法在近些年的发展过程中,生物发光技术应用范围很广,是一种比较快速的检测微生物的技术。在活性细胞中,ATP是其常见的能量代谢产。如何从小鼠的乳鼠组织中分离出心肌细胞。四川小鼠原代细胞分离培养厂家
SD大鼠肾小管上皮细胞怎么分离。天津纤维化原代细胞分离培养价格
染方法大致可分为物理介导(如电穿孔法、显微注射和基因等)、化学介导(脂质体及其代替物、磷酸钙等)和生物介导(各类病毒,包括腺病毒、慢病毒、逆转录病毒、腺相关病毒等)三类途径。细胞转染又分为瞬时转染和稳定转染,瞬时转染是指外源基因进入受体细胞后,存在于游离的载体上,不整合到细胞的染色体上,基因表达维持时间较短,通常在96h以内;稳定转染是指DNA整合到宿主细胞的染色体中,使宿主细胞可长期表达目的基因。目前,大多采用依据不同质粒载体含有的抗性标志选用相应的对靶细胞进行筛选,常用的有嘌呤霉素(Puromycin)、G418(Geneticin)等。1、主要有下面几种化学法:磷酸钙法、DEAE-右旋糖苷法、阳离子脂质体法;物理法:电穿孔法、显微注射法、biolistic颗粒传递法;病毒介导法:逆转录病毒、腺病毒A.阳离子脂质体法:带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞。特点:简单通用,适用性广,转染效率高,重复性好,但转染时需除血清,转染效率随细胞类型变化大。由于脂质体复合物与贴壁细胞的接触机会远大于悬浮细胞,所以贴壁比悬浮转染效率要高。悬浮细胞建议使用电穿孔法。B.电穿孔法:利用高压电脉冲对细胞膜的干扰。天津纤维化原代细胞分离培养价格