在生命科学研究中,细胞培养是一项基础且**的技术 —— 小到分子机制探索,大到药物筛选、细胞***研发,都离不开健康、稳定的细胞体系。但对新手而言,细胞污染、生长缓慢、形态异常等问题常常让人头疼;即使是***研究者,也可能因操作细节疏忽导致实验 “翻车”。***,我们就从细胞培养的**原理出发,梳理从准备工作到日常维护的全流程要点,再聊聊常见问题的解决方案,帮你轻松搞定细胞培养!

一、细胞培养前:做好这些准备,成功一半
细胞对环境极其敏感,温度、湿度、无菌状态等任何微小偏差,都可能影响其生长。因此,实验前的准备工作必须 “精益求精”。
1. **耗材:选对、灭菌是关键
细胞培养的耗材直接接触细胞,其质量和无菌性是基础中的基础,常见耗材及注意事项如下:
培养容器:根据实验需求选择培养皿(直径 6cm/10cm)、培养瓶(T25/T75/T175)或多孔板(6 孔 / 12 孔 / 24 孔 / 96 孔)。优先选择TC 处理(组织培养处理) 的耗材 —— 这类耗材表面经过特殊涂层,能促进细胞贴壁生长(悬浮细胞可忽略此要求)。使用前需检查包装是否完好,避免因运输或储存不当导致污染。
培养基与添加剂:不同细胞系对培养基的需求差异极大,比如 HeLa 细胞常用 DMEM,CHO 细胞偏好 F12,原代细胞则可能需要**培养基。关键注意点:
✅ 培养基需添加胎牛血清(FBS) (通常终浓度 10%-20%),提供细胞生长所需的营养因子;
✅ 加入双抗(青霉素 - 链霉素) (终浓度 1%),预防细菌污染(特殊实验如细胞***需无抗培养);
✅ 部分细胞需额外添加特定因子,如内皮细胞需 VEGF,神经细胞需 BDNF,需严格参照细胞说明书。培养基配制后需 4℃避光储存,且储存时间不超过 2 周,避免营养成分降解。
其他耗材:移液管、离心管、***头需选择无菌无酶规格,避免酶类物质破坏细胞膜;酒精棉球、无菌手套、口罩需提前准备,确保操作过程无菌。
2. 仪器检查:确保设备处于比较好状态
细胞培养依赖的**仪器需提前调试,避免实验中 “掉链子”:
CO₂培养箱:温度需稳定在 37℃(误差 ±0.5℃),CO₂浓度通常为 5%(维持培养基 pH 稳定,依赖 NaHCO₃缓冲体系),相对湿度保持在 95% 以上(防止培养基蒸发)。使用前需用酒精擦拭内壁,定期(每 1-2 周)进行紫外消毒,避免霉菌滋生。
超净工作台:开启前需紫外线消毒 30 分钟,消毒后通风 15 分钟再进行操作(避免紫外线残留损伤细胞)。操作时需保持台面整洁,*放置必要耗材,避免手臂频繁进出破坏无菌环境。
离心机:用于细胞传代或换液时的离心操作,需提前校准转速(通常细胞离心转速为 1000-1500rpm,时间 3-5 分钟,避免转速过高损伤细胞)。
倒置显微镜:用于观察细胞形态和生长状态,需提前调整焦距和光源,确保视野清晰。
二、细胞培养中:掌握**操作,避免 “踩坑”
细胞培养的日常操作主要包括换液和传代,这两个步骤直接决定细胞的生长状态,需严格遵循规范。
1. 换液:及时补充营养,移除代谢废物
当培养基颜色从桃红色(pH 正常)变为黄色(pH 下降,代谢废物积累),或细胞生长至 50%-70% 密度时,需进行换液:
准备工作:将新鲜培养基提前从 4℃取出,复温至室温(约 30 分钟,避免低温刺激细胞);超净工作台紫外线消毒后通风,戴无菌手套、口罩,用 75% 酒精擦拭双手和耗材表面。
操作步骤:
打开培养箱,取出培养皿 / 瓶,用酒精棉球擦拭外壁后放入超净台;
用移液管轻轻吸出旧培养基(注意避免吸到贴壁细胞,悬浮细胞需先离心收集再换液);
用无菌 PBS(磷酸盐缓冲液)清洗细胞 1-2 次(移除残留的血清和代谢废物,避免影响新培养基营养);
加入适量新鲜培养基(培养皿直径 6cm 加 2-3ml,T25 培养瓶加 5ml,确保覆盖细胞即可,过多会浪费且影响气体交换);
轻轻晃动培养容器,使培养基均匀分布,放回 CO₂培养箱。
2. 传代:避免细胞过度生长,维持活性
当贴壁细胞生长至 80%-90% 融合度(细胞铺满培养皿表面,无明显间隙),或悬浮细胞密度达到 1×10⁶-5×10⁶ cells/ml 时,需进行传代,防止细胞因空间不足或营养匮乏进入衰老期:
贴壁细胞传代(以胰酶消化法为例):
按换液步骤移除旧培养基,用 PBS 清洗细胞 1 次;
加入适量胰酶(T25 培养瓶加 1ml,覆盖细胞表面即可),放入 37℃培养箱孵育 1-3 分钟(不同细胞对胰酶敏感性不同,需在显微镜下观察,当细胞间隙增大、开始脱落时立即终止消化);
加入含血清的新鲜培养基(血清中的胰酶抑制剂可终止消化),用移液管轻轻吹打细胞(动作要轻柔,避免产生过多气泡损伤细胞),制成单细胞悬液;
取适量细胞悬液(根据传代比例,通常 1:2-1:5 传代,如 T25 瓶细胞传到 2-5 个新 T25 瓶),加入新鲜培养基,混匀后放回培养箱。
悬浮细胞传代:
直接将细胞悬液转移至离心管,1000rpm 离心 5 分钟;
弃上清,加入新鲜培养基重悬细胞;
按比例分装到新的培养容器中,放回培养箱。
三、细胞培养后:观察与记录,及时发现问题
细胞培养不是 “一放了之”,每天的观察和记录至关重要,能帮助我们及时发现异常,避免实验损失。
1. 日常观察要点
每天在倒置显微镜下观察细胞,重点关注 3 个方面:
细胞形态:不同细胞有其特征形态,如 HeLa 细胞呈上皮样、梭形,CHO 细胞呈圆形或多边形。若细胞出现皱缩、破碎、贴壁不牢,可能是消化过度、污染或培养基不适导致。
生长密度:记录细胞融合度(贴壁细胞)或密度(悬浮细胞),判断是否需要换液或传代。若细胞生长缓慢,需排查培养基是否过期、血清质量是否下降、培养箱温度 / CO₂浓度是否异常。
是否污染:污染是细胞培养的 “天敌”,常见污染类型及识别方法:
细菌污染:培养基迅速变浑浊(黄色或乳白色),显微镜下可见大量小圆点,快速游动或布朗运动;
***污染:培养基表面出现白色、绿色或黑色菌丝,或出现圆形孢子,污染初期培养基可能不变浑浊,但细胞会逐渐死亡;
支原体污染:支原体直径* 0.2-0.3μm,普通光学显微镜下难以观察,需通过支原体检测试剂盒(如 PCR 法、荧光染色法)鉴定,污染后细胞生长缓慢、形态异常,且会影响实验结果(如干扰细胞信号通路、改变基因表达)。
2. 记录与冻存
实验记录:每次操作(换液、传代、观察)需详细记录,包括日期、细胞名称、操作步骤、细胞状态(形态、密度)、培养基批次、血清批次等,便于后续追溯问题。
细胞冻存:当细胞生长状态良好时,需及时冻存,避免细胞长期传代导致遗传漂变或污染丢失。冻存液通常为 “培养基:血清:DMSO=7:2:1”(DMSO 为冷冻保护剂,需缓慢加入,避免损伤细胞),冻存过程需遵循 “梯度降温” 原则:4℃放置 30 分钟→-20℃放置 1-2 小时→-80℃过夜→转入液氮长期储存。
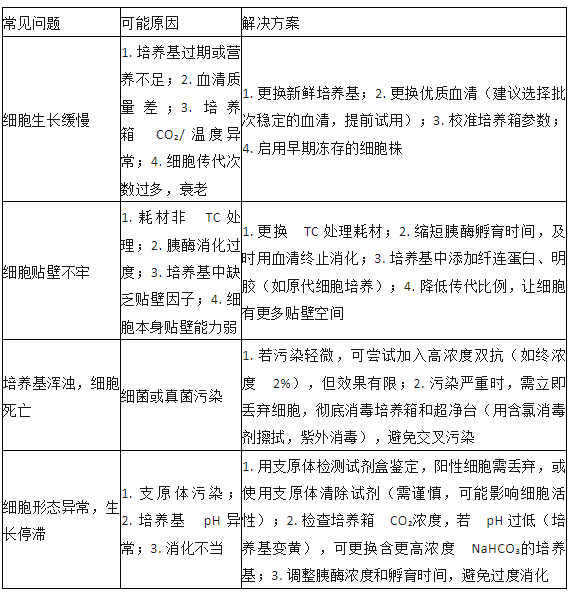
四、常见问题 troubleshooting:解决你的 “细胞焦虑”
即使操作规范,细胞培养中也可能出现各种问题,以下是高频问题及解决方案:
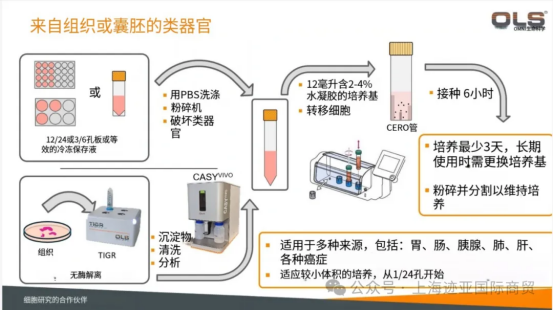
五、OMNI Life Science 其他细胞研究解决方案
除了 CASY VIVO 细胞计数仪,OMNI Life Science 还提供多款适配细胞研究的设备,满足不同实验需求:
TIGR 组织研磨解离仪:快速温和处理组织,无需酶解,可同时处理 4 个样本,适合组织单细胞悬液制备;
CERO 3D 培养箱生物反应器:专为 3D 细胞培养设计,支持类球体、类***或组织培养,产量高且操作简便,助力 3D 细胞研究突破。
写在***
细胞培养是一门 “技术 + 耐心” 的学问,没有谁能一蹴而就。新手不必因初期的 “失败” 气馁,多观察、多记录、多总结,熟悉自己培养的细胞特性,就能逐渐掌握技巧。记住:无菌意识贯穿始终,细节决定成败 —— 做好每一步,你的细胞自然会 “健康成长”,为后续实验打下坚实基础!
如果在细胞培养中遇到其他棘手问题,欢迎在评论区留言,我们一起探讨解决方案~
关注我们了解更多内容

OLS OMNI Life Science认证的中国授权经销商:

上海迹亚国际商贸有限公司
Gaia China Co.,Ltd.