商机详情 -
太原CDP-STAR化学发光底物
生物医学应用方面,ABEI的磁分离特性与化学发光活性形成协同效应。与中国科学技术大学合作的研究中,ABEI/CoFe₂O₄/石墨烯复合材料在碱性条件下表现出80倍于ABEI/石墨烯的发光强度,其磁饱和强度达12.5 emu/g,可通过外部磁场快速分离。这种特性在疾病标志物检测中具有明显优势:以氨基末端脑钠肽前体(NT-proBNP)为例,通过戊二醛将单克隆抗体修饰于复合材料表面后,构建的电化学发光免疫传感器检测范围覆盖1.0×10⁻¹⁰至1.0×10⁻¹⁴ g/mL,且在30天储存期内发光强度衰减不足5%。临床验证表明,该传感器对心力衰竭患者的诊断符合率达99.2%,较传统酶联免疫吸附法(ELISA)提升12%。在环境监测领域,ABEI功能化材料已成功应用于重金属离子检测:通过与吖啶黄构建荧光共振能量转移体系,无需额外连接分子即可实现水溶液中铜离子的定量检测,检测限低至0.3 nM,且在pH 5-9范围内保持95%以上的回收率。化学发光物在激光技术研究中提供参考,探索新型激光产生方式。太原CDP-STAR化学发光底物
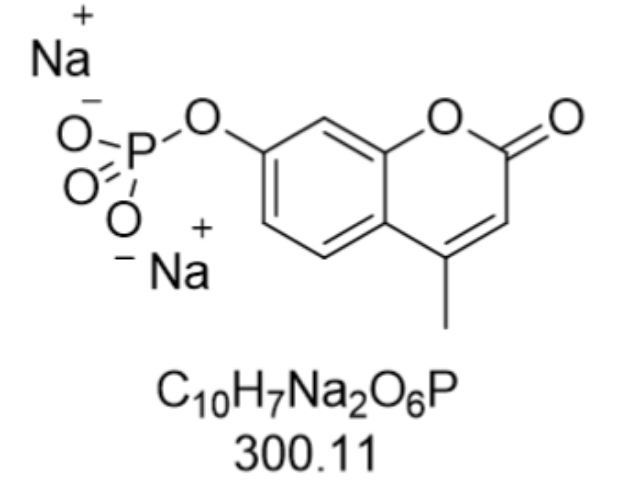
鲁米诺钠盐,化学式为Luminol sodium salt,CAS号为20666-12-0,是一种在法医、刑事侦查以及环境监测领域普遍应用的化学发光试剂。其独特的化学性质使得它在与血液、某些细菌代谢产物或氧化剂接触时能发出强烈的蓝绿色荧光,这一特性使其在犯罪现场勘查中成为寻找潜在血迹、追踪犯罪线索的得力助手。鲁米诺钠盐的发光反应不仅灵敏度高,而且操作相对简便,只需在黑暗环境下,将鲁米诺溶液喷洒在疑似有血迹的区域,通过紫外线或过氧化氢等激发剂的作用,即便微量血迹也能迅速显现,极大地提高了证据收集的效率与准确性。这种化学发光技术在环境污染物检测方面同样展现出巨大潜力,能够快速识别出被污染区域,为环境保护提供有力的技术支持。太原CDP-STAR化学发光底物化学发光物在智能公交中用于制作发光车身,增加辨识度。
鲁米诺的生物相容性与衍生开发潜力进一步拓展了其性能边界。在生物医学研究中,鲁米诺被用于检测细胞内的活性氧(ROS)和铁代谢异常。通过标记鲁米诺的纳米探针可实时监测线粒体ROS水平,在某项疾病研究中,该技术成功捕捉到疾病细胞与正常细胞在氧化应激状态下的差异。在免疫分析领域,鲁米诺与链霉亲和素结合形成的发光标记物,可将ELISA检测灵敏度提升至pg/mL级别,在某型传染病早期诊断中,该技术使检测窗口期缩短3天。近年来,研究人员通过结构修饰开发出异鲁米诺(Isoluminol)、氨基乙基异鲁米诺(AE-Isoluminol)等衍生物,这些化合物在保持高发光效率的同时,水溶性提升5倍,更适用于水相体系检测。某生物科技公司开发的鲁米诺-磁性微球复合试剂,通过磁场富集目标物后进行化学发光检测,将血液中疾病标志物的检测限降低至0.1ng/mL。这些衍生开发不仅保留了鲁米诺的重要性能,还通过功能化改造满足了不同领域的定制化需求,推动其从传统法医工具向高级生物检测平台转型。
生物相容性是评估化学发光标记物性能的关键指标,NSP-SA-NHS在此方面展现出明显优势。其分子结构中的磺酸基团通过氢键作用增强与蛋白质表面的静电吸附,同时酰胺键的形成未改变抗体等生物分子的三级结构。红外光谱分析显示,标记后的IgG抗体在1650cm⁻¹处的酰胺I带与1540cm⁻¹处的酰胺II带强度比保持稳定,表明抗原结合位点未受破坏。圆二色光谱(CD)检测进一步证实,标记过程对抗体α螺旋与β折叠结构的扰动小于5%,远低于传统荧光素FITC(扰动率>15%)的标记影响。在储存稳定性方面,NSP-SA-NHS标记的抗体复合物在4℃酸性缓冲液(含0.02%叠氮钠)中保存30天后,发光强度只下降12%,而-20℃冷冻条件下12个月后活性保持率超过85%。这种优异的稳定性使其成为体外诊断试剂盒开发的理想选择,特别适用于需要长途运输或长期储存的临床检测场景。不同化学发光物发光波长不同,有的发红光,有的发绿光,应用场景有差异。
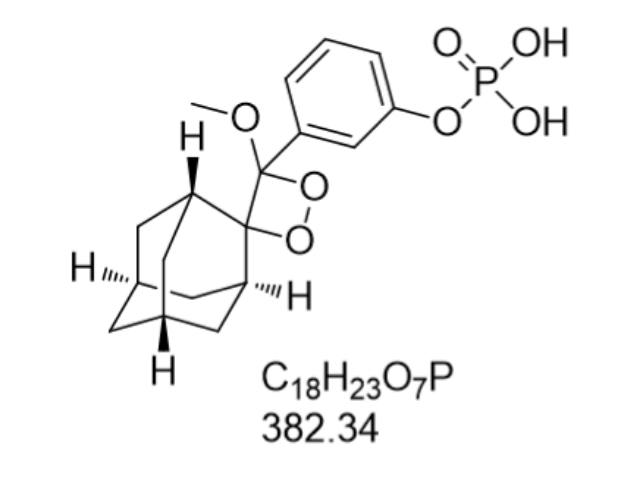
链脲菌素(Streptozotocin,CAS: 18883-66-4)是一种具有明显生物学活性的化合物,普遍应用于糖尿病研究与医治中。作为一种广谱的衍生物,它通过特定的机制选择性破坏胰腺中的β细胞,这些细胞负责生产调节血糖水平的胰岛素。链脲菌素进入β细胞后,会被葡萄糖-6-磷酸酶分解为自由基,这些自由基随即引发DNA损伤和细胞凋亡,从而导致胰岛素分泌减少,血糖水平上升。在科研领域,链脲菌素常被用来诱导实验动物产生糖尿病模型,帮助科学家们深入理解糖尿病的发病机制,探索新的医治方法和药物。由于其高度的细胞毒性,使用时需严格控制剂量,以避免对非目标细胞造成不必要的伤害。化学发光物在黑暗中发出迷人的光芒,常用于夜光手表和紧急出口标志。太原CDP-STAR化学发光底物
化学发光物在电影拍摄中用于制作发光道具,增强电影真实感。太原CDP-STAR化学发光底物
腔肠素(Coelenterazine,CAS号:55779-48-1)作为一种天然荧光素,普遍分布于水母、海肾等海洋生物体内,其化学结构为3,2-二氢-2-(对羟基苯甲基)-6-(对羟基苯基)-8-苄基咪唑并[1,2-a]吡嗪-3-酮,分子式C₂₆H₂₁N₃O₃,分子量423.46 g/mol。自1975年科学家初次确认其结构并实现人工合成以来,腔肠素已成为生物发光领域的关键底物。其重要特性在于无需三磷酸腺苷(ATP)参与即可通过氧化反应产生蓝色荧光(发射波长450-480 nm),这一机制与萤火虫荧光素/荧光素酶系统形成鲜明对比。在钙依赖性反应中,腔肠素作为水母发光蛋白(Aequorin)的辅因子,与钙离子结合后被氧化生成高能中间体Coelenteramide,同时释放CO₂并发出466 nm的蓝光,这一特性使其成为监测活细胞内钙离子动态的黄金标准。在神经生物学研究中,腔肠素标记的水母发光蛋白复合物可连续数小时监测神经元钙信号波动,其信噪比远超传统荧光染料,且背景荧光极低。太原CDP-STAR化学发光底物