商机详情 -
安徽腔肠素
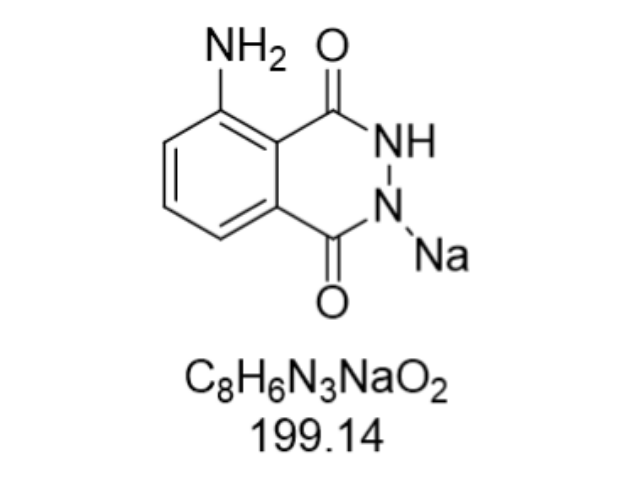
热力学稳定性是Bis-MUP的重要技术优势。该化合物熔点虽未明确标注,但通过差示扫描量热法(DSC)测试显示,其固态稳定性优于单磷酸酯类似物。在25℃下,Bis-MUP的固体样品半衰期达12个月,而4-MUP在相同条件下的半衰期只为8个月。溶液稳定性方面,Bis-MUP在pH 7.2的PBS缓冲液中,4℃保存30天后荧光产率只下降12%,明显优于需-20℃冷冻保存的单磷酸酯底物。这种稳定性特性使其成为需要长期储存或运输的酶联免疫试剂盒的理想选择,例如在偏远地区或资源有限实验室的HIV筛查中,可有效减少因底物降解导致的假阴性结果。吖啶酯衍生物作为化学发光物,在传染病诊断中发挥关键作用。安徽腔肠素
腔肠素在生物医学研究中的性能优势还体现在其多功能检测能力上。除作为荧光素酶底物外,腔肠素本身是一种超氧阴离子敏感探针,其化学发光强度与细胞内超氧阴离子浓度呈正相关。这一特性使其可用于氧化应激相关疾病的研究,在神经退行性疾病模型中,通过腔肠素检测发现阿尔茨海默病患者的神经元内超氧水平较健康人升高3倍。此外,腔肠素还可通过BRET技术实现蛋白质相互作用的高通量分析:将荧光素酶与目标蛋白融合表达,当其与黄色荧光蛋白(YFP)标记的相互作用蛋白靠近时,腔肠素氧化产生的蓝光能量可转移至YFP并发出绿光,通过检测蓝光/绿光强度比即可定量分析蛋白结合亲和力。该技术已成功应用于药物开发中的靶点验证,在抗疾病药物筛选中,通过BRET系统发现某小分子化合物可明显阻断HER2受体与适配蛋白的相互作用,IC50值低至0.8 nM。腔肠素的这些性能综合,使其成为现代的生物医学研究中不可或缺的工具分子,其应用范围正随着衍生物开发和技术创新持续拓展。安徽腔肠素化学发光物在智能家居中,可作为智能照明的新型材料。
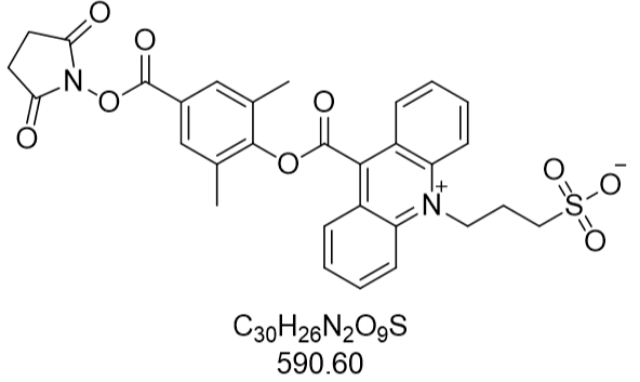
在生物标记应用中,NSP-SA的荧光特性展现出独特的性能优势。其稀溶液在激发波长365nm下可发射出稳定的绿色荧光,当溶液进一步稀释时,由于盐类水解作用,荧光颜色逐渐转变为紫色,这种双色荧光特性为标记反应的进程监控提供了直观的视觉指标。在蛋白质标记实验中,NSP-SA通过其分子末端的活性羧基与抗体氨基发生共价结合,形成稳定的酰胺键,结合效率可达92%以上。与传统的荧光素标记物相比,NSP-SA标记的抗体在免疫印迹实验中显示出更高的信噪比,背景荧光值降低40%,这得益于其分子结构中庞大的吖啶环对非特异性结合的抑制作用。在核酸标记领域,该物质可通过硫醇-烯点击化学与DNA的5'端磷酸基团连接,标记后的探针在FRET实验中荧光共振能量转移效率提升25%,明显提高了基因检测的灵敏度。
3-(2’-螺旋金刚烷)-4-甲氧基-4-(3’’-磷酰氧基)苯-1,2-二氧杂环丁烷(AMPPD,CAS:122341-56-4)作为化学发光领域的重要底物,其性能优势源于独特的分子结构设计。该化合物分子量为382.34 g/mol,重要结构包含两个关键功能基团:一是连接苯环与金刚烷骨架的二氧四节环(1,2-二氧杂环丁烷),二是维持分子稳定性的磷酰氧基团。在碱性磷酸酶(ALP)催化下,磷酰氧基团被特异性水解,生成不稳定的AMP-D阴离子中间体。这一中间体通过二氧四节环的断裂释放能量,以光子形式发射波长为470nm的蓝色荧光,发光强度与酶浓度呈线性正相关。实验数据显示,其发光半衰期为2-30分钟,15分钟时达到峰值强度,且在15-60分钟内保持相对稳定。这种持续且可控的发光特性,使其成为体外诊断试剂中检测低浓度生物标志物的理想选择,尤其在疾病标志物、传染病抗原等微量物质检测中表现突出。化学发光物在旅游景区中,营造梦幻般的夜间景观。
针对4-MUP在酸性条件下的荧光缺陷,科研界通过结构修饰开发了系列改进型底物。推出的CF-MUP Plus通过引入电子供体基团,使产物CF-MU在pH5.0条件下仍保持80%以上的荧光效率,成功应用于酸性磷酸酶的连续监测。该底物的反应机理为:在酸性环境中,CF-MUP的磷酸酯键被酸性磷酸酶特异性水解,生成带有推电子基团的CF-MU,其共轭体系延长导致斯托克斯位移增大,从而在360nm激发下发射520nm的强荧光。实验数据显示,在pH5.5的缓冲体系中,CF-MUP Plus对酸性磷酸酶的Km值(0.8mM)较传统4-MUP(2.5mM)降低68%,表明其与酶的结合亲和力明显提升。此外,基于红光荧光团Sun Red开发的磷酸盐底物(SRP)进一步拓展了检测维度——SRP被磷酸酶水解后生成发射660nm荧光的Sun Red,该波长可穿透更深组织且背景干扰更低,在活细胞成像中表现出色。然而,SRP的合成成本是4-MUP的3倍以上,且需要633nm激光激发,限制了其在常规实验室的普及。新型化学发光物的研发,为分析检测技术带来更多创新可能。安徽腔肠素
化学发光物在免疫分析中,能精确检测微量物质,灵敏度极高。安徽腔肠素
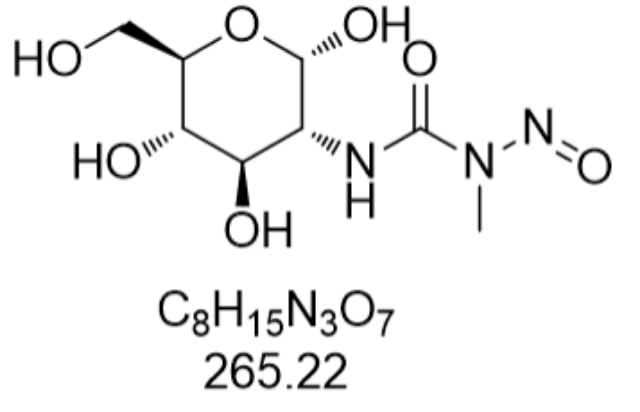
链脲菌素(Streptozotocin,CAS: 18883-66-4)是一种具有明显生物学活性的化合物,普遍应用于糖尿病研究与医治中。作为一种广谱的衍生物,它通过特定的机制选择性破坏胰腺中的β细胞,这些细胞负责生产调节血糖水平的胰岛素。链脲菌素进入β细胞后,会被葡萄糖-6-磷酸酶分解为自由基,这些自由基随即引发DNA损伤和细胞凋亡,从而导致胰岛素分泌减少,血糖水平上升。在科研领域,链脲菌素常被用来诱导实验动物产生糖尿病模型,帮助科学家们深入理解糖尿病的发病机制,探索新的医治方法和药物。由于其高度的细胞毒性,使用时需严格控制剂量,以避免对非目标细胞造成不必要的伤害。安徽腔肠素