商机详情 -
武汉哺乳动物纺锤体卵冷冻研究
在卵母细胞冷冻保存过程中,纺锤体的形态变化是评估冷冻效果的重要指标之一。传统的纺锤体观察方法往往需要将卵母细胞固定并进行免疫荧光染色,这不仅破坏了细胞的活性,还限制了进一步观察其发育潜能的机会。而偏光成像技术则能够在不解冻、不染色的情况下,直接观察纺锤体的形态变化。通过Polscope系统,研究者可以实时监测冷冻过程中纺锤体的形态变化,评估冷冻保护剂对纺锤体的保护效果,以及解冻后纺锤体的恢复情况。冷冻后的卵母细胞纺锤体及染色体异常率增高,这将直接影响解冻后卵母细胞的减数分裂进程和胚胎的染色体正常性。利用偏光成像技术,研究者可以准确评估冷冻前后纺锤体的异常率,包括纺锤体的形态、位置、稳定性等参数。通过对比分析,可以明确冷冻过程对纺锤体的具体影响,为优化冷冻保存条件提供科学依据。研究纺锤体有助于理解细胞分裂的分子机制。武汉哺乳动物纺锤体卵冷冻研究
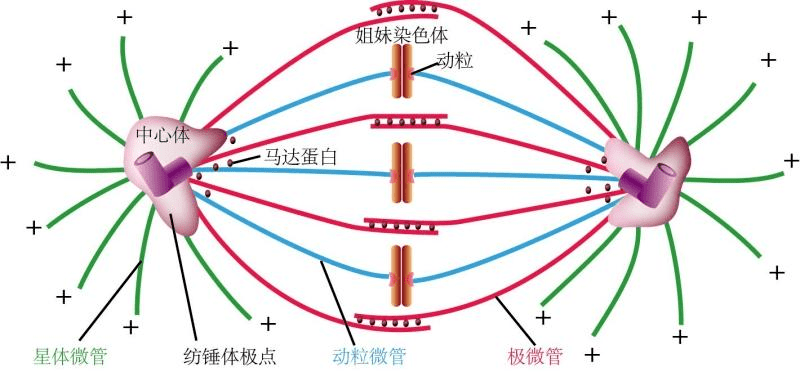
冷冻与解冻过程中涉及多个环节,包括温度控制、时间控制、冷冻保护剂的添加与去除等。这些环节中的任何一步操作不当都可能导致纺锤体损伤。因此,需要不断优化冷冻与解冻技术,以减少对纺锤体的不良影响。近年来,研究者们通过不断尝试和优化冷冻保护剂的配方,取得了进展。例如,甘油、二甲基亚砜(DMSO)等渗透性保护剂被用于哺乳动物卵母细胞的冷冻保存中,它们能够迅速降低细胞内水分含量,减少冰晶形成。同时,一些非渗透性保护剂如蔗糖、海藻糖等也被发现对纺锤体具有一定的保护作用。香港偏光成像纺锤体卵质量评估纺锤体微管网络的复杂性确保了细胞分裂的精确性和高效性。
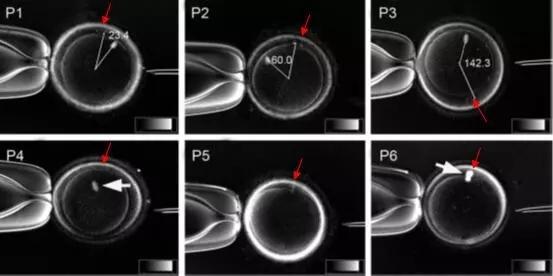
尽管纺锤体成像技术已经取得了明显的进展,但仍存在一些挑战和限制。例如,目前的高分辨率成像技术往往需要对样品进行特殊处理或标记,这可能会对细胞的活性和功能产生影响。此外,成像速度和分辨率之间仍存在权衡关系,如何在保持高分辨率的同时提高成像速度是当前研究的重点之一。未来,随着成像技术的不断创新和进步,纺锤体成像技术有望实现更高的分辨率、更快的成像速度和更好的细胞活性保持能力。例如,基于量子点的荧光标记技术、基于人工智能的图像重建算法以及基于超快激光的成像技术等都有望为纺锤体成像技术的发展带来新的突破。此外,结合其他细胞生物学技术,如基因编辑、蛋白质组学等,纺锤体成像技术将能够更深入地揭示细胞分裂的复杂机制和纺锤体的功能作用。
在纺锤体卵冷冻过程中,利用纺锤体实时成像技术可以实时监测纺锤体的变化。通过观察冷冻过程中纺锤体的形态、位置及动态变化,研究者可以判断冷冻保护剂的效果、冷冻速率等因素对纺锤体的影响,从而优化冷冻方案,减少纺锤体损伤。解冻后,利用纺锤体实时成像技术可以对卵母细胞内的纺锤体进行再次评估。通过比较解冻前后纺锤体的形态和稳定性,研究者可以判断冷冻过程对纺锤体的损伤程度,并筛选出纺锤体形态完好的卵母细胞进行后续操作,提高受精率和胚胎发育质量。纺锤体微管的稳定性受到细胞内外多种信号的调节。
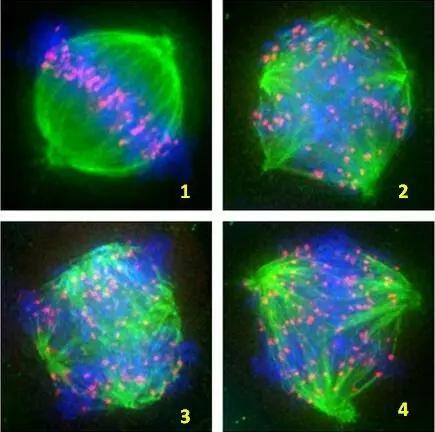
为了减少冷冻过程中纺锤体的损伤,研究者们尝试在冷冻液及解冻液中添加细胞骨架保护剂,如紫杉醇(Taxol)。紫杉醇能够稳定微管结构,防止其在低温下解聚。通过偏光成像技术,研究者可以实时监测紫杉醇对纺锤体的保护效果,评估其在冷冻保存过程中的作用机制。此外,还可以进一步观察解冻后卵母细胞的发育潜能,为临床应用提供可靠依据。无需对细胞进行固定和染色,保持细胞的活性与完整性。能够实时监测纺锤体的形态变化,评估冷冻效果。能够捕捉到细微的纺锤体形态变化,提高评估的准确性。纺锤体的形成需要多种蛋白质的参与,包括微管相关蛋白和中心体蛋白等。香港偏光成像纺锤体胚胎发育
纺锤体在减数分裂中也发挥重要作用,确保生殖细胞染色体正确分离。武汉哺乳动物纺锤体卵冷冻研究
纺锤体的双极化是卵母细胞减数分裂过程中的关键事件之一。近年来,我国学者在人类卵母细胞纺锤体双极化机制研究方面取得了重要进展。通过高分辨成像技术,研究者们揭示了人类卵母细胞纺锤体双极化的独特机制,并发现了调控此过程的关键蛋白。这些研究成果不仅为双折射性纺锤体卵冷冻研究提供了新的视角和思路,也为临床生殖障碍疾病的诊疗提供了科学依据。随着偏光成像技术和冷冻保护剂研究的不断深入,未来有望开发出更加高效、安全的卵母细胞冷冻保存方案。例如,通过改进冷冻速率和程序、优化保护剂配方等手段,进一步减轻冷冻损伤,提高解冻后卵母细胞的存活率和发育潜能。武汉哺乳动物纺锤体卵冷冻研究