商机详情 -
昆明成熟卵母细胞纺锤体胚胎植入
秋水仙素会使动物细胞染色体加倍吗微管蛋白按照来源可分为植物微管蛋白和动物脑蛋白。因植物微管蛋白难以制备,秋水仙碱与动物脑微管蛋白结合反应研究得要更多一些。秋水仙碱是从植物秋水仙中提纯出的一种生物碱,又名秋水仙素,构成微管的α、β微管蛋白异源二聚体是秋水仙素分子的结合靶点。当秋水仙碱与正在进行有丝分裂的细胞接触时,秋水仙碱结合到微管蛋白的特定位点,导致α微管蛋白与β微管蛋白二聚体结构变形,从而阻断微管蛋白组装成微管,但并不影响微管蛋白的解聚,所以纺锤体会迅速消失。
秋水仙碱的浓度和作用时间对动、植物细胞染色体加倍的影响是关键。有研究结果表明,在花粉母细胞减数分裂细线期与粗线期进行美洲黑杨2n花粉的诱导效果比较好,总体上在减数分裂粗线期进行诱导得到的2n花粉**多,并且诱导的比较好浓度为0.5%。刘爱生等在利用人类外周血淋巴细胞进行染色体G显带制作中,在阻断培养的4h内任意时间加入相应剂量的秋水仙素,能获得用于G显带的形态完好、大小适中、分散均匀、轮廓清楚的中期染色体标本相。陈长超等利用秋水仙碱处理MⅠ期卵母细胞,结果发现Ml期纺锤体发生解聚,染色体周围纺锤体微管全部消失或部分残留,染色体排列异常。 纺锤体在细胞分裂过程中经历明显的形态和结构变化。昆明成熟卵母细胞纺锤体胚胎植入
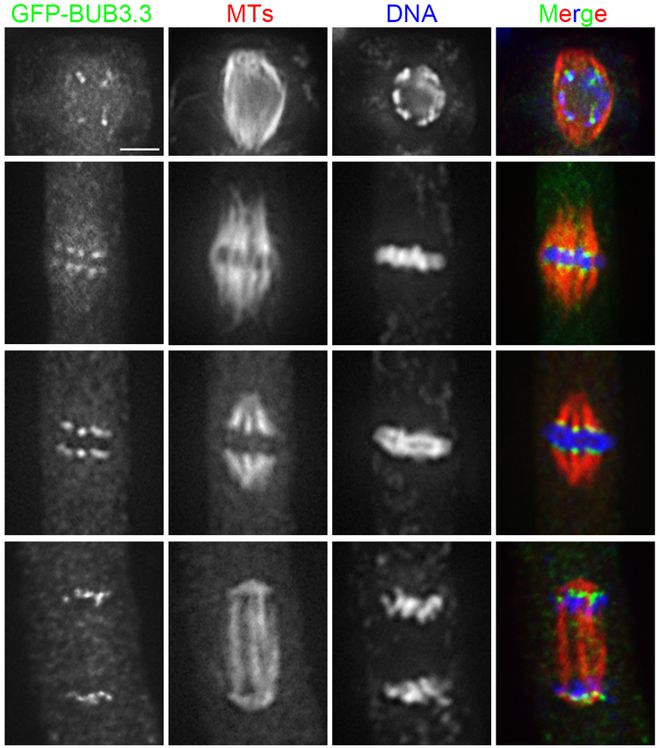
卵母细胞纺锤体对低温环境极为敏感,冷冻过程中可能发生的冰晶形成、溶液浓缩等物理化学变化均会对纺锤体造成损伤,导致其形态异常、稳定性下降。在冷冻和解冻过程中,纺锤体微管可能发生解聚和重聚,这一过程不仅影响纺锤体的形态,还可能破坏其内部结构和功能,进而影响卵母细胞的发育潜能。为了减轻冷冻损伤,研究者们尝试在冷冻液中添加细胞骨架保护剂,如紫杉醇等。然而,保护剂的选择、浓度及作用机制仍需进一步研究和优化。武汉卵母细胞纺锤体透明带纺锤体在细胞分裂完成后迅速解体,为细胞进入下一个周期做准备。
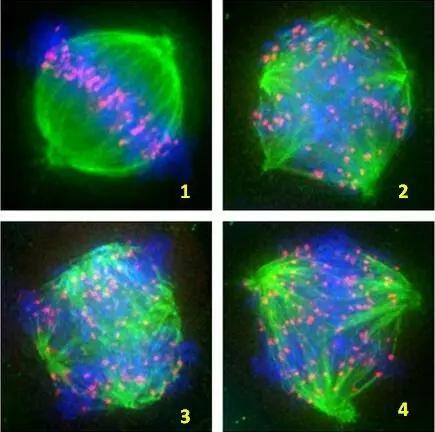
如何观察纺锤体呢?
在普通光学显微镜下,人类卵母细胞是半透明的,无法对纺锤体的结构进行观察和分析。传统方法是用一种特异的DNA荧光染料对卵母细胞染色,在紫外光下可显示纺锤体,这种免疫荧光方法对卵母细胞有损伤,不能应用于临床。为了更好的观测纺锤体,美国海洋生物学实验室的R.Oldenbourg等利用纺锤体的双折射特性,开发出偏振光显微镜。现今,偏振光显微镜已经发展成为一种无创性的观察和分析纺锤体动态结构的显微观测系统,我们也叫它纺锤体观测仪。它不仅能对双折射性纺锤体信号的有无进行定性分析,还能对信号的强弱进行定量分析。
纺锤体的完整性决定了染色体分裂的正确性。在有丝分裂前期,中心体被复制形成两个中心体,并逐渐分离,形成两个纺锤体。纺锤体的微管从中心体发出,与染色体上的着丝粒(kinetochore)结合。着丝粒是一组复杂的蛋白质结构,可以与微管的末端结合。当纤维束的微管末端与着丝粒结合时,纤维束开始缩短,将染色体拉向两端,实现染色体的精确分离。这一过程不仅确保了每个新细胞都能获得正确数量的染色体,还保证了遗传信息的稳定传递。纺锤体在细胞分裂后期通过微管切割机制实现染色体分离。
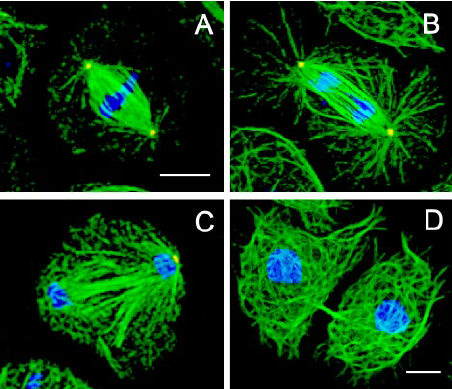
哺乳动物卵母细胞的纺锤体由微管组成,这些微管结构精细且高度动态,对温度、渗透压和机械力等外界因素极为敏感。在冷冻过程中,纺锤体容易因冰晶形成、渗透压变化或机械损伤而遭到破坏,导致染色体分离异常,进而影响卵母细胞的发育潜力和受精后的胚胎质量。选择合适的冷冻保护剂是减少纺锤体损伤的关键。然而,不同浓度的冷冻保护剂对纺锤体的影响各异,且不同哺乳动物种类之间也存在差异。因此,需要通过大量实验来优化冷冻保护剂的配方,以大限度地保护纺锤体的完整性。纺锤体形态的变化反映了细胞分裂的不同阶段。武汉辅助生殖纺锤体加热台
纺锤体形成缺陷是多种遗传疾病的共同特征。昆明成熟卵母细胞纺锤体胚胎植入
在生殖医学领域,卵母细胞的冷冻保存技术一直是研究的热点之一,旨在提高女性生育能力的保存与利用。然而,传统纺锤体观察方法往往需要对卵母细胞进行固定和染色,这不仅破坏了细胞的活性,还限制了对其发育潜能的进一步评估。传统纺锤体观察方法,如免疫荧光染色技术,虽然能够清晰地展示纺锤体的形态,但其缺点在于需要对细胞进行固定和染色处理,这一过程不可避免地会对细胞造成损伤,影响后续的实验结果和临床应用。而Polscope偏振光显微成像系统则通过利用纺锤体微管结构的双折射性,实现了对无需染色纺锤体的直接观察。这一技术创新不仅保留了细胞的活性与完整性,还提高了观察的实时性和动态性,为卵母细胞冷冻研究提供了更为准确和可靠的评估手段。昆明成熟卵母细胞纺锤体胚胎植入