商机详情 -
美国辅助生殖纺锤体卵冷冻研究
染色体
当细胞从间期进入有丝分裂期,间期细胞微管网络解聚为游离的αβ-微管蛋白二聚体,再重组成纺锤体,介导染色体的运动;分裂末期纺锤体微管解聚,又重组形成细胞质微管网络。
可分为:动粒微管:连接染色体动粒于两极的微管。
极间微管:从两极发出,在纺锤体中部赤道区相互交错的微管。
星体微管:中心体周围呈辐射分布的微管。
染色体的运动依赖纺锤体微管的组装和去组装。在这一过程中动粒微管与动粒之间的滑动主要是依靠结合在动粒部位的驱动蛋白和动力蛋白沿微管的运动来完成。极微管在纺锤体中部交错,有些分布在极微管之间特殊的双极马达蛋白,其中2个马达蛋白沿一条微管运动,另2个马达结构域沿另一条微管运动。由于2条微管分别来自二极,故极性相反。当双极驱动蛋白四聚体沿微管向正极运动时,纺锤体二极间距离延长。反之纺锤体距离缩短。 纺锤体形态的变化反映了细胞分裂的不同阶段。美国辅助生殖纺锤体卵冷冻研究
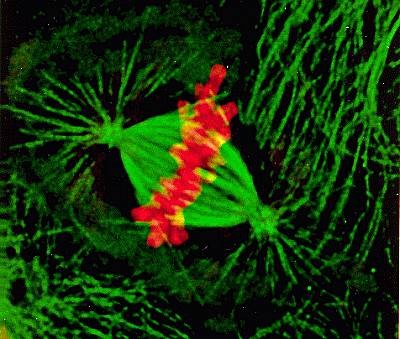
纺锤体的双极化是卵母细胞减数分裂过程中的关键事件之一。近年来,我国学者在人类卵母细胞纺锤体双极化机制研究方面取得了重要进展。通过高分辨成像技术,研究者们揭示了人类卵母细胞纺锤体双极化的独特机制,并发现了调控此过程的关键蛋白。这些研究成果不仅为双折射性纺锤体卵冷冻研究提供了新的视角和思路,也为临床生殖障碍疾病的诊疗提供了科学依据。随着偏光成像技术和冷冻保护剂研究的不断深入,未来有望开发出更加高效、安全的卵母细胞冷冻保存方案。例如,通过改进冷冻速率和程序、优化保护剂配方等手段,进一步减轻冷冻损伤,提高解冻后卵母细胞的存活率和发育潜能。美国ICSI纺锤体观测仪纺锤体微管的动态不稳定性是其功能的基础。
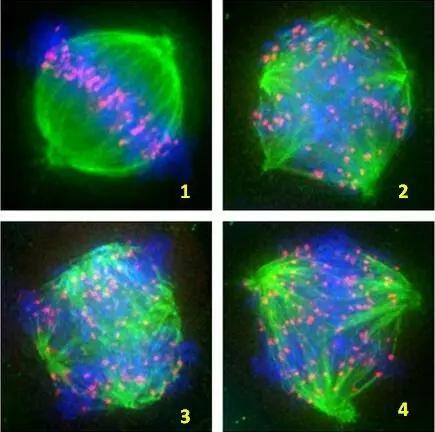
无需染色纺锤体观察技术能够实时监测冷冻过程中纺锤体的形态变化,从而准确评估冷冻保存的效果。通过对比冷冻前后纺锤体的形态和稳定性,研究者可以优化冷冻保护剂的配方和浓度,以及改进冷冻程序,减少冷冻损伤,提高解冻后卵母细胞的存活率和发育潜能。解冻后的卵母细胞在无需染色的情况下,可以直接通过Polscope系统进行纺锤体观察。这一技术能够迅速评估解冻后卵母细胞的质量,包括纺锤体的形态、位置、稳定性等关键指标,为后续的受精和胚胎发育提供重要参考。
纺锤体是如何形成的(2)
动粒微管连接染色体动粒与位于两极的中心体。在有丝分裂前期,一旦核被膜解聚,由相反两个方向的中心体伸出的动粒微管就会随机地与染色体上的动粒结合而俘获染色体,微管**终附着在动粒上,动粒微管把染色体和纺锤体连接在一起。在细胞分裂期的后期,分开后的染色单体被拉向两极。染色体移动由两个相互独立且同步进行的过程所介导,分别为过程A和过程B。在过程A中,在连接微管和动粒的马达蛋白的作用下,动粒微管解聚缩短,在动粒处产生的拉力使染色体移向两极。极间微管是从一个中心体伸出的某些微管与从另一个中心体伸出的微管相互作用,阻止了它们的解聚,从而使微管结构相对稳定,两套微管的这种结合形成了有丝分裂纺锤体的基本框架,具有典型的两极形态,产生这些微管的两个中心体称为纺锤极,这些相互作用的微管被称为极间微管。在有丝分裂后期过程B中,极间微管的伸长和相互间的滑行使纺锤极向两极方向移动。星体微管从中心体向周围呈辐射状分布,在有丝分裂后期过程B中,每一纺锤极上向外伸展的星体微管发出向外的力,拉动两个纺锤极向两极方向移动。
纺锤体在细胞分裂中扮演关键角色,确保遗传物质均等分配。
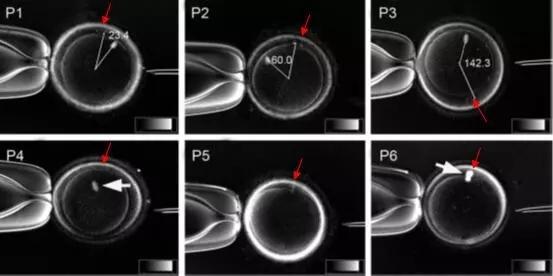
纺锤体的完整性决定了染色体分裂的正确性。在有丝分裂前期,中心体被复制形成两个中心体,并逐渐分离,形成两个纺锤体。纺锤体的微管从中心体发出,与染色体上的着丝粒(kinetochore)结合。着丝粒是一组复杂的蛋白质结构,可以与微管的末端结合。当纤维束的微管末端与着丝粒结合时,纤维束开始缩短,将染色体拉向两端,实现染色体的精确分离。这一过程不仅确保了每个新细胞都能获得正确数量的染色体,还保证了遗传信息的稳定传递。纺锤体微管的动态变化是细胞对外界刺激响应的一部分。上海核移植纺锤体价格
纺锤体的形成与细胞骨架的重构密切相关。美国辅助生殖纺锤体卵冷冻研究
在生殖医学领域,卵母细胞的冷冻保存技术一直是研究的热点,旨在提高女性生育能力的保存与利用。然而,传统的纺锤体观察方法往往需要对卵母细胞进行固定和染色处理,这不仅破坏了细胞的活性,还限制了对其发育潜能的深入评估。偏光成像技术,特别是Polscope偏振光显微成像系统,通过利用纺锤体微管结构的双折射性,实现了对纺锤体的无损观察。这种技术无需对卵母细胞进行固定和染色,能够在保持细胞活性的同时,实时、动态地观察纺锤体的形态和变化。这不仅提高了观察的准确性和可靠性,还避免了传统染色方法可能带来的细胞损伤和误差。美国辅助生殖纺锤体卵冷冻研究