商机详情 -
合肥神经生物学实用膜片钳应用
膜片钳技术原理:膜片钳技术的建立,对生物学科学特别是神经科学是一资有重大意义的变革。这是一种以记录通过离子通道的离子电流来反映细胞膜单一的(或多个的离子通道分子活动的技术。些技术的出现自然将细胞水平和分子水平的生理学研究联系在一起,同时又将神经科学的不同分野必然地融汇在一起,改变了既往各个分野互不联系、互不渗透,阻碍人们很全认识能力的弊端。由于电极与细胞膜的高阻封接,在电极笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就替代单一离子通道电流。被孤立的小膜片面积为微米数量级,因此封接范围内细胞膜光有少数离子通道。合肥神经生物学实用膜片钳应用

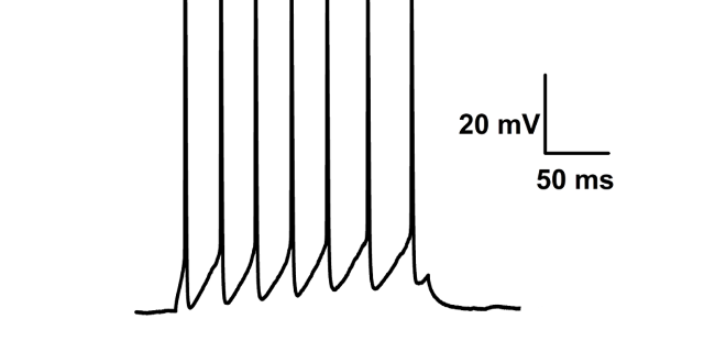
膜片钳记录的几种形式:全细胞记录构型(whole-cell recording) 高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。它既可记录膜电位又可记录膜电流。其中膜电位可在电流钳情况下记录,或将玻管连到标准高阻微电极放大器上记录。在电压钳条件下记录到的大细胞全细胞电流可达nA级,全细胞钳的串联电阻(玻管和细胞内部之间的电阻)应当补偿。任何流经膜的电流均流经这一电阻,所引起的电压降将使玻管电压不同于细胞内的真正电位。电流愈大,愈需对串联电阻进行补偿。合肥神经生物学实用膜片钳应用膜片钳的数据如何处理:全细胞式膜片方式使细胞内与浴槽之间的漏流极少。
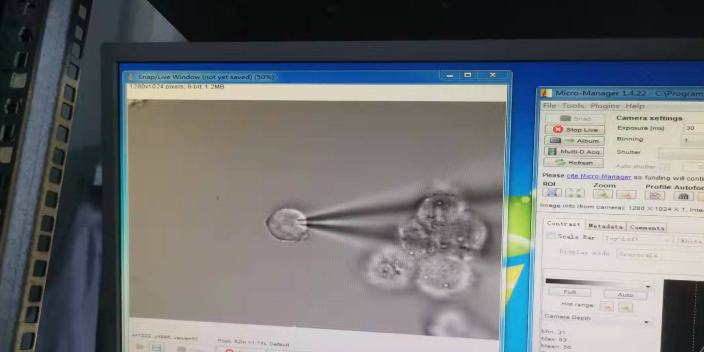
膜片钳电生理记录技术:膜片钳技术的基本原理:膜片钳技术用特制的玻璃微吸管吸附于细胞表面,使之形成10~100MΩ的高阻封接,被孤立的小膜片面积为微米数量级,因此封接范围内细胞膜光有少数离子通道。然后对该膜片实行电压钳位,测量单个离子通道开放产生的微小电流,这种通道的开放是一种随机过程。通过观测单个通道开放的电流幅值分布、开放概率、开放寿命分布等功能参数,并分析它们与膜电位、离子浓度等之间的关系。将该部分细胞采用负压吸破,可以形成比较常见的全细胞记录模式,可以研究整个细胞的生理功能和离子通道电生理功能。
膜片钳只适用于药物的初筛和二次筛选,且对样本有很高的选择性,而传统的膜片钳技术可适用于各种样本,应用范围广,能够分析检测所有的离子通道类型,同时能够分析离子通道的动力学特征。因此目前,传统膜片钳技术仍然是不可替代的。在进行膜片钳实验时,玻璃电极给负压并吸住细胞,形成高阻封接,破膜,给药,记录数据的过程,都需要细胞保持比较好的活性状态,才能更加高效的获得有效数据。因此细胞的稳定性就成了评估样品好坏的关键。膜片钳使用的注意事项:非必须用到汞灯时请不要打开汞灯电源,打开后至少需1个小时才可关闭。
膜片钳电生理纪录系统及记录方法:细胞膜由双层脂膜组成,具有密封绝缘的特性,因此当纪录 电极接触到细胞膜时电阻会开始上升,然后以人工方式对纪录电极内施加一个负压,可以让电极与胞膜之间吸附得更为紧密而电阻也会加速上升,当纪录电极的电阻达到千兆欧姆(Giga Ω)时,意味着细胞膜与电极之间几乎没有电流漏出,之后对电极内压力施以一个快速的负压将细胞膜吸破,这样纪录电极与细胞胞体之间会形成一个封闭的电容,此时就可以开始对细胞进行实验。为了测量在不同药物对细胞中的离子通道的影响,通常需要在膜片钳实验中实施灌流。合肥神经生物学实用膜片钳应用
膜片钳的数据如何处理:通过渗透很快改变胞浆成分并达到平衡,该手段在全细胞记录中广泛应用。合肥神经生物学实用膜片钳应用
膜片钳实验常见问题及解决方法:膜片钳实验难度大、技术要求高,要掌握有关技术和方法虽不是很困难的事,但要从一大批的实验数据中,经过处理和分析,得出有意义、有价值的结果和结论,就显得不那么容易,有许多需要注意和考虑的问题,包括减少噪音,避免电极前端的污染,提高封接成功率,具体实验过程中还需要考虑如何选取记录模式,为记录特定离子电流如何选择电极内、外液,如何选择阻断剂、激动剂,如何进行正确的数据采集等许多更为复杂的问题,还需在科研实践中不断地探索和解决。合肥神经生物学实用膜片钳应用