商机详情 -
疾病科研技术服务技术
二甲苯Ⅰ、Ⅱ各15min至透明。(2)放入二甲苯和石蜡等量混合液处理15min,再放入石蜡Ⅰ、Ⅱ透蜡各50~60min。透蜡在恒温箱内进行,箱内温度保持在55~60℃左右。4、包埋(1)用镊子夹取蜡模在酒精灯上稍加热,并倒入少许从温箱中取出的纯石蜡。(2)再将镊子在酒精灯上稍加热,夹取材料将切面朝下放入蜡模中,排列整齐,再放上包埋盒,轻轻倒入熔蜡。5、切片、展片、贴片(1)将包埋好的石蜡块固定在切片机上,调整厚度调节器到所需的切片厚度,一般为4~6μm。(2)切下的组织薄片要放到加热的水中烫平,再贴到载玻片上,放45℃恒温箱中烘干。二、HE染色1、脱蜡、复水(1)保持水浴锅温度为60℃,将切片放入干燥的染色缸内,放入水浴锅中,30min至蜡熔化。(2)石蜡切片经二甲苯Ⅰ、Ⅱ脱蜡各5min,然后放入100%、95%、90%、80%、70%各级酒精溶液中各3~5min,再放入蒸馏水中3min,以便染料可以进入组织。2、染色、脱水(1)切片放入苏木精中染色约10~30min,用流水冲洗约15min,使切片颜色变蓝。(2)将切片放入1%盐酸乙醇液中褪色,几秒后见切片变红、颜色较浅即可,后将切片再放入流水中使其恢复蓝色。(3)切片放入50%、70%、80%乙醇中各3~5min。细胞转染又分为瞬时转染和稳定转染,瞬时转染是指外源基因进入受体细胞后.疾病科研技术服务技术

动物模型在科研中有着普遍的应用。首先,它们可以帮助科研人员深入理解的共同性,即不同物种之间存在的共有理变化过程。通过对动物模型的研究,科研人员可以更清楚地了解的发展过程和机制,为人类的检查提供理论依据。其次,动物模型还为新研发和苗测试提供了的平台。在研发过程中,科研人员可以通过对动物模型进行处理,观察其和副作用,为新的临床试验提供依据。而在苗测试中,动物模型则可以用来评估苗的性和安全性。此外,动物模型还为科研人员提供了研究人类的跨学科方法。例如,通过比较人类和动物模型的基因组学、蛋白质组学等数据,可以发现与发生相关的关键基因和蛋白质,从而为的和检查提供新的思路。虽然动物模型在科研中发挥了巨大的作用,但也存在一些挑战。首先,由于物种差异的存在,动物模型的表现与人类可能存在差异,因此需要谨慎使用。此外,动物模型的伦理问题也不容忽视,科研人员需要在符合伦理规定的前提下进行相关研究。尽管存在挑战,动物模型的发展前景仍然值得期待。随着科技的不断进步,科研人员将能够开发出更为精确、实用的动物模型。血液科研技术服务实验室上海研录生物医药为您提供一站式科研技术服务。
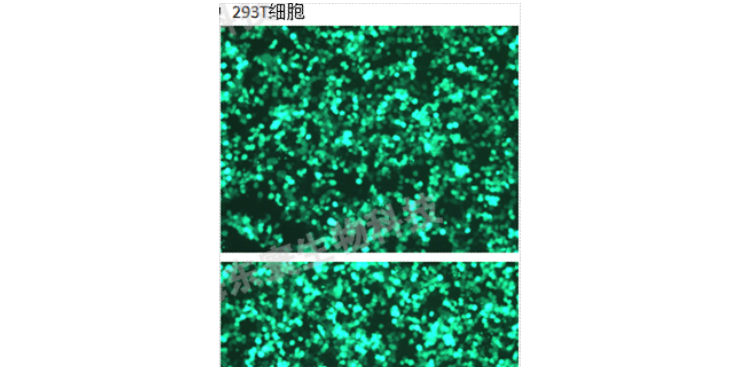
原理以慢病毒包装为例,主要包括3个质粒:质粒DNA可以转录出慢病毒遗传物质(RNA),但不能翻译出慢病毒的外壳及蛋白成分的载体质粒,其同时含有目的基因和报告基因,psPAX2是可以表达慢病毒外壳的质粒,其表达产物可通过粘附机制更易穿过细胞膜。为慢病毒的膜蛋白质粒,通过脂质体进行三质粒共转到靶细胞基因组中,宿主基因组在表达时,随宿主基因转录出的目的基因RNA与psPAX2、基因翻译出的蛋白组装为慢病毒。病毒进入细胞后,其遗传物质RNA逆转录出DNA,该基因再整合到靶细胞的基因组中,完成转染过程。因为质粒DNA只能转录出病毒RNA和表达目的基因却不能表达出病毒的外壳和膜蛋白成分,因此其不能像普通的病毒一样在宿主细胞能反复增殖,故对宿主细胞是无害的并且高效的将目的基因转染到靶细胞基因组中。用途病毒产生,包装病毒。材料与仪器无菌1×PBS,对数期293T细胞,细胞计数器,病毒质粒(以慢病毒为例:psPAX2/),转染试剂(lipMax或者lipo3000),Polybrene、病毒浓缩液(生物公司有售)等。步骤(1)293T细胞铺板取对数生长期的293T细胞,用的胰蛋白酶消化293T细胞,计数。若是10cm大皿,建议按照10-12×106每皿的数量将293T细胞均匀铺入。若是6孔板。
小鼠尾尖用酒精擦拭尾巴,引起轻微的血管扩张;用无菌手术刀、刀片或锋利的剪刀,快速截断小鼠尾尖1-2毫米。如果需要多次,之后每次需截除2-3毫米;从尾部像尾尖方向按摩,增加血流;用采集血液;结束后,按压伤口或使用止血剂来止血;每次量大约可达。小鼠眼球取血单手保定好小鼠;必要时剪掉小鼠胡须,防止污染血液;轻压取血侧眼部皮肤,使眼球充血突出;用弯头镊夹取眼球并快速在摘取;同时用左手中指轻按小鼠心脏部位,以加快心脏泵血速度;当血液流尽时,用脱臼法处死小鼠;大鼠眼眶取血先将小鼠进行麻醉,大鼠翻正反射消失时不在继续麻醉;抗凝处理过的玻璃毛细采样管,掰成2-3厘米长度;右手食指和拇指轻按眼眶两侧皮肤,使眼球突出,毛细管从内侧的眼球与眼睑的缝隙处进入,轻轻旋转毛细管,稍微深入眼球后上方,血液流速快的时候4-5滴即可,温柔的将毛细管取出;用棉签按压大鼠眼眶止血,每次可取血50-100微升,将血液放入冰盒中保存。小鼠心脏取血先将小鼠麻醉,稍靠右侧平躺在手术板上固定;左侧第三四根肋骨间触摸心脏,跳动明显,慢慢进针;针有回血停止进针,开始取血;一次可以300到500微升,小鼠存活,放到加热垫上待小鼠苏醒后放入笼中。科普知识 —了解IgM、IgG、IgA、IgE四种抗体。

代谢组学的研究对象大都是相对分子量在1000以内的小分子物质,因此常用的血液样本在取样后,应小心操作,防止溶血,尽快分离出血清,分置于温环境下保存。由于用于理实验的动物采集相对其他样品的采集,操作更繁琐,在处理过程中许多细节容易忽略,造成数据不完美(甚至不能用)。因此接下来将重点介绍样品采集的注意事项及其固定。样品采集注意事项应新鲜,操作时间尽可能短,否则细胞发生死后变化、自融及现象。是动物心脏还在跳动时采集,样本取出后在5分钟以内置于固定液内,避免长时间暴露在空气环境中。块尽量小而薄。块的厚度以不超过5mm为宜,较为理想的厚度为2mm左右,主要目的是使固定液迅速而均匀的渗入块内部。勿使块受挤压。在采集过程中,应尽量选择较为锋利的手术,如手术刀片等,避免操作过程中挤压挫伤标本。挤压过的均不可用。固定液的量一般以块大小的20倍为宜,能够在容器内自由移动。尽量保持的原有形态。新鲜经固定后,或多或少产生收缩现象(如胃肠),为此可将展平,以尽可能维持原形。保持清洁。块上如有血液、污物、粘液、食物、粪便等,可用生理盐水冲洗,然后再入固定液,但要注意防止损伤。要熟悉采集部位。要能准确的按解剖部位采集。细胞划痕(wound healing)法是简捷测定细胞迁移运动和修复能力的方法。广西裸鼠科研技术服务构建
动物造模 | 脓毒症造模方法之CLP造模法。疾病科研技术服务技术
m6A修饰图谱构建及作用机制:通过m6A甲基化测序(MeRIP-Seq,miCLIP)构建疾病细胞模型或者发病组织的m6A修饰谱,分析m6A的motif,peaks数量及分布,Peak关联基因的特征,联合RNA-seq研究m6A甲基化与表达的关系。m6A研究思路方案一方案二研究案例1、.(IF=)为研究ALKBH5的m6A作用机制,作者利用芯片和m6A-seq筛选到胶质瘤增殖相关的FOXM1,通过qPCR、WB、免疫荧光、核质分离WB/qPCR、RIP和MeRIP等实验证明ALKBH5通过去甲基化调节FOXM1在GSCs中的表达。为研究ALKBH5对FOXM1的作用是否受其他因子的调节,作者研究了FOXM1的邻近基因,发现lncRNAFOXM1-AS与FOXM1序列互补,且共表达、共定位,进一步通过RIP,RNApulldown等实验证明lncRNAFOXM1-AS促进ALKBH5和FOXM1初级转录本的相互作用。通过细胞实验进一步验证ALKBH5在lncRNAFOXM1-AS的作用下维持FOXM1的表达和细胞增殖,从而维持GSCs的干性。图3ALKBH5敲除细胞中m6A修饰的特征和基因表达的变化2、RNAN6-methyladenosinemethyltransferaseMETTL3promoteslivercancerprogressionHepatology,2017.(IF=)表观遗传改变极大地促进了人类症的发生。传统的表观遗传研究主要集中在DNA甲基化,组蛋白修饰和染色质重构。近。疾病科研技术服务技术