商机详情 -
天津科研技术服务构建
用伊红乙醇液对比染色1~3min。(4)将切片放入95%乙醇中洗去多余的红色,然后放入无水乙醇中3~5min,吸干后将切片放入二甲苯Ⅰ、Ⅱ中各3~5min。3、观察在镜下可见卵巢呈扁椭圆形,表面为单层扁平上皮细胞或单层立方上皮,卵巢实质分为皮质和髓质。可见上皮,原始卵泡和生长卵泡。卵巢组织中各发育阶段卵泡及卵巢基质的形态结构清晰可见,细胞核呈蓝紫色,细胞质及间质成分呈浅红色,卵泡中卵母细胞、卵泡细胞、透明带均清晰可见。注意事项1.取材注意事项(1)取材动作要迅速,不宜作太久的拖延以免组织细胞的成分、结构等发生变化。(2)切片材料应根据需要观察的部位进行选择,尽可能不要损伤所需要的部分。(3)切取的组织块不宜太大,以利于固定剂穿透,通常以5mmx5mmx2mm或10mmx10mmx2mm为宜。2.固定注意事项(1)一般固定液,都以新配为好,配好后应贮存在阴凉处,不宜放在日光下,以免引起化学变化,失去固定作用。(2)有些混合固定液的成份之间会发生氧化还原作用,一定要在使用前才混合,如果混合太早,固定时就没有作用了。(3)固定材料时,固定液必须充足,一般为材料块的20~30倍,有些水分多的材料,中间应更换1~2次新液。(4)材料固定完毕后。科研小白如何摸索自己的预实验。天津科研技术服务构建
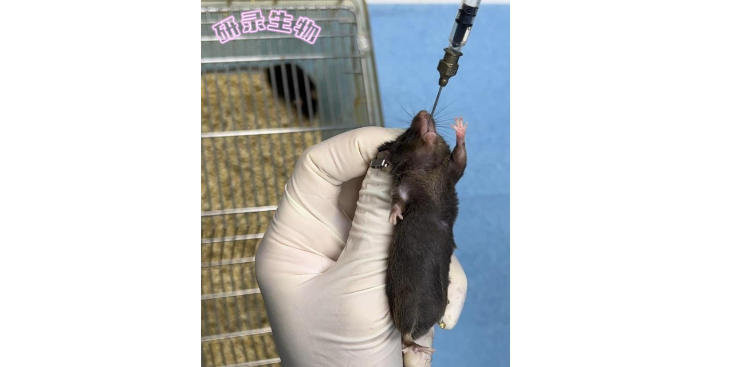
原理以慢病毒包装为例,主要包括3个质粒:质粒DNA可以转录出慢病毒遗传物质(RNA),但不能翻译出慢病毒的外壳及蛋白成分的载体质粒,其同时含有目的基因和报告基因,psPAX2是可以表达慢病毒外壳的质粒,其表达产物可通过粘附机制更易穿过细胞膜。为慢病毒的膜蛋白质粒,通过脂质体进行三质粒共转到靶细胞基因组中,宿主基因组在表达时,随宿主基因转录出的目的基因RNA与psPAX2、基因翻译出的蛋白组装为慢病毒。病毒进入细胞后,其遗传物质RNA逆转录出DNA,该基因再整合到靶细胞的基因组中,完成转染过程。因为质粒DNA只能转录出病毒RNA和表达目的基因却不能表达出病毒的外壳和膜蛋白成分,因此其不能像普通的病毒一样在宿主细胞能反复增殖,故对宿主细胞是无害的并且高效的将目的基因转染到靶细胞基因组中。用途病毒产生,包装病毒。材料与仪器无菌1×PBS,对数期293T细胞,细胞计数器,病毒质粒(以慢病毒为例:psPAX2/),转染试剂(lipMax或者lipo3000),Polybrene、病毒浓缩液(生物公司有售)等。步骤(1)293T细胞铺板取对数生长期的293T细胞,用的胰蛋白酶消化293T细胞,计数。若是10cm大皿,建议按照10-12×106每皿的数量将293T细胞均匀铺入。若是6孔板。海南组织科研技术服务服务肿瘤细胞侵袭能力检测在学(迁移、侵袭)和免疫学(迁移、趋化)中是常规实验。

且研究表明HNRNPC通过m6A与RNA结合调控目标转录本的丰度和选择性剪切[9].图1m6A修饰的酶系统[10]m6A生物学功能越来越多的证据表明m6A修饰在哺乳动物中发挥重要的生物功能。例如,在转录水平上调控RNA的稳定性[11]、定位[12]、运输、剪切[13]和翻译[14]。ClaudioR.等发现依赖METTL3的pri-miRNA甲基化,会促进DGCR8识别和加工,从而促进microRNA的成熟[15]。此外,m6A识别蛋白HNRNPA2B1促进pri-miRNA加工成pre-miRNA[16]。另外,环状RNA上m6A的修饰能促进环状RNA的翻译[17]。m6A修饰在基因表达调控中起着重要的作用,其调控机制的异常可能与人类疾病或相关。目前发现m6A可能会影响精子发育(ALKBH5,METTL3,Ythdc2)、发育(METTL3、FTO、ALKBH5)、免疫(METTL3)、UV诱导的DNA损伤反应(METTL3,FTO)、生成(YTHDF2)或转移(METTL14)、干细胞更新(METTL14)、脂肪分化(FTO)、生物节律、细胞发育分化、细胞分裂及其它的一些生命过程。例如,ALKBH5敲除的雄性小鼠增加了mRNA中的m(6)A修饰,其特点是凋亡影响减数分裂中期的精子细胞,引起生育能力受损[7]。METTL3和METTL14增加弱精症精子的m6A水平[18],在生殖细胞中,METTL3的敲除严重抑制精子分化和减数分裂的发生。
1.首要原则:细胞不重要情况下立即丢弃,培养箱灭菌,所用培养基也都要丢弃,器械等重新灭菌或拆用新的。2.细菌污染一般都救不回来了,发现的时候培养基一般都很浑浊且细胞都死了3.污染且细胞很重要时:遇到念球菌污染,且细胞为基因改造细胞,非常重要。如231贴壁乳腺细胞,发现细胞周围出现很小的串珠透亮圆点,非常像念球菌污染,此时细胞状态尚可,且污染少。处理如下:用预热或室温PBS清洗3次,可适当振摇,将污染冲洗下来。随后加入10-20%双抗到培养瓶,置于37度培养箱1h,之后再用PBS清洗三遍,直至视野下无可见污染。此时细胞也被冲下大部分,因此此方法只适用在细胞贴壁强,状态好,密度高时使用。之后每天再更换培养基,每次用PBS冲洗2遍。过几天细胞状态尚可时,消化离心时用500r,3min,去掉上清,重复3次。这个方法是根据文献可利用念球菌和细胞体积重量差异实现分离。基本上这一步做完以后,污染就基本了,接下来就注意多观察,勤换液就行。人工模型是指通过人工手段制造的疾病模型。
图2MAZTER-Seq实验流程图图3MAZTER-MINE分析m6A示意图接下来作者便是要验证这一新方法的可行性了。在酵母中敲除IME4的情况下,检测到的剪切效率高于野生型(剪切效率高低m6A水平),m6A抗体富集后的样品剪切效率也低于未富集的Input组。整体水平可靠,那检测的特异性位点是否准确呢?作者也将该方法检测到的新甲基化位点使用放射标记层析检测,发现预测的位点准确存在而且与剪切效率相符合。如图5所示。而图6中,作者则是与m6A抗体IP的方法进行了比较,也证实了这一方法的可行性。图5MAZTER-Seq检测结果验证图6MAZTER-Seq与m6A-Seq比较分析此外,后文中作者也在大规模的CRISPR-Cas9改变m6A状态和酵母减数分裂模型中检测了MAZTER-Seq这一系统;并进一步通过这一方法检测了哺乳动物不同细胞间m6A水平的保守性;也探究了去甲基化酶FTO对整体m6A甲基化水平的影响等。这里小编主要给大家分享这一新技术,其他部分暂不过多分析了。新的技术能拓展我们的研究内容;对于这一技术。瘤细胞的增殖活性,从而更好地评估肿、瘤的恶性程度和预后.天津大鼠科研技术服务构建
可以普遍应用于生物医学研究、药物筛选、肿、瘤诊断等领域。天津科研技术服务构建
痉挛型脑性瘫痪(SCP)大鼠模型【简介】痉挛性脑瘫指发育异常引起的运动和感觉功能落后,造成肢体肌张力增高、腱反射亢进等一系列综合征。本实验利用脑立体定位解剖图谱,对大鼠的锥体束部位进行精确的立体定位,通过微量注射器对大脑锥体束所在部位注射无水乙醇造成锥体束坏死,的模拟了痉挛型脑瘫的解剖学及病理改变,术后大鼠产生明显的屈曲痉挛症状,且屈肌肌张力增高,症状和体持续时间较长,稳定性良好。从而建立一种可复制性良好且痉挛持续时间较长的稳定的大鼠痉挛型脑瘫动物模型,为进一步深入的探究痉挛型脑瘫的基础研究和临床诊治打下基础【目的】痉挛型脑性瘫痪(SCP)大鼠模型建立【动物】SPF级SD大鼠,雄性,周龄6~8W,体重:200~250g【方法】1、大鼠麻醉,颅顶脱毛备皮;2、大鼠脑定位仪固定大鼠,颅顶正中切口,长度约2cm开口暴露前囟及矢状缝;3、缝线将皮肤左右分开固定,前囟后10mm、矢状缝左侧;4、微量注射器移至开孔处修正骨孔,注射器垂直向颅内插入,缓慢注射无水乙醇15ul,注射完移除注射器,棉球压迫止血;5、缝合创口后维持25°体温,等待苏醒,观察大鼠状态。【观察】术后3天模型大鼠摄食减少、右侧肢体跛行、右前肢不负重、右前肢及右前爪屈曲痉挛明显。天津科研技术服务构建