商机详情 -
云南500mM盐浓度条件高盐核酸酶
ArcticZymes厂家对盐活性核酸酶系列产品(Salt Active Nucleases,SANs)的生产及质控,包括SAN HQ高盐核酸酶和M-SAN HQ中盐核酸酶,在符合ISO13485:2016体系基础上,增加了cGMP质控标准,如microbes、endotoxin、蛋白酶等;同时提供TSE/BSE声明、无动物源(Animal-Origin Free)声明、非转基因声明等文件协助药物申报。此外,ArcticZymes的生产场地接受客户的定期审计,其第三方审计文件已得到国际TOP CDMO及Biotech的认可,并已经成为国际TOP CDMO的供应商。具体文件体系可以跟厂家或对应销售人员联系。SAN HQ高盐核酸酶有助于减少了宿主细胞残留DNA的污染,提高了基因药物的安全性。云南500mM盐浓度条件高盐核酸酶

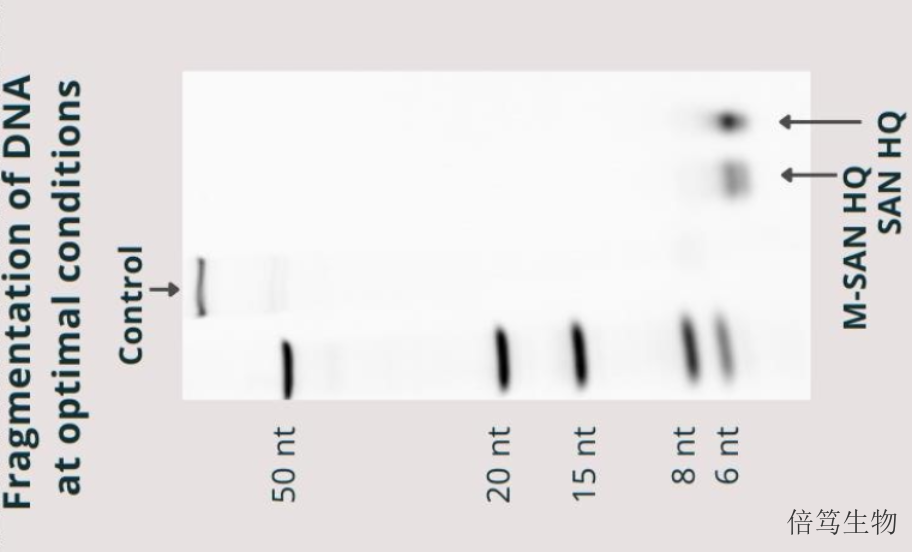
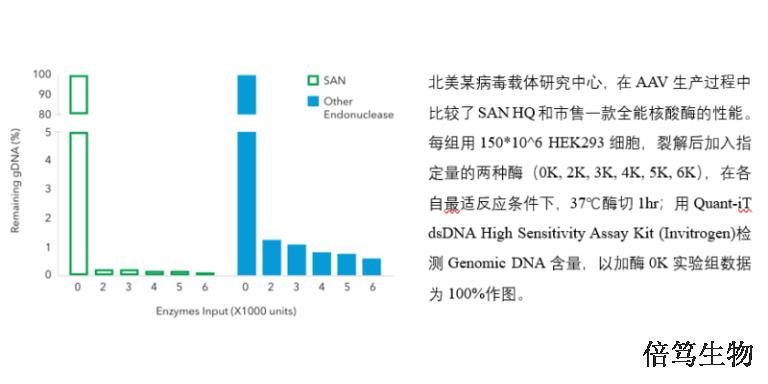
宿主细胞DNA(HCD)残留以染色质形式存在,其中有带负电荷的DNA、带正电荷及疏水区段的组蛋白,就像胶带一样能够吸附很多物质,包括各种杂蛋白、色谱填料、目的病毒颗粒。非特异吸附杂蛋白,会影响蛋白杂质(如HCP)等的去除;吸附到色谱填料上,会降低色谱分离纯化效率;吸附到目的病毒颗粒时,会影响目的产物的稳定性,从而降低目的产物的得率。因此,从生产工艺层面来讲,一定要去除HCD,从而能够简化工艺、提高目的产物的产量。上海高盐核酸酶70921-160SAN HQ GMP是全球shou款市售GMP级别高盐核酸酶,于2023年Q4上市。
监管部门对HCD的残留量有明确的规定。美国FDA发布的指导原则中指出生物制品HCD残余限度为 100pg/剂,对于大剂量生物制品如单克隆抗体,根据其残留DNA来源及给药途径,残留量可放宽至 10ng/剂。细胞基因药物终产品的DNA残留有两种来源,分别是宿主细胞DNA(HCD)和转染用的质粒。质粒和HCD的存在形式不同,去除效率也差别很大。其中,质粒是裸露的DNA双链,带强负电荷,通过色谱纯化主要是离子交换能够很高效去除;HCD则是以核小体紧密折叠形成的染色质形式存在,几乎不以裸DNA形式存在,所以很难去除。
上海倍笃生物科技有限公司(简称“倍笃生物”),由中国科学院及生物医药产业界人士,于2018年1月共同创立。公司代理多个品牌的仪器、试剂及耗材,遵守相关法规要求,如cGMP规范、ISO13485质量管理体系认证等,致力于为诊断领域如分子诊断及病原微生物检测研发等,药物研发领域如细胞基因药物、核酸药物、抗体药物、干细胞及外泌体研究等客户提供合规、高质量物料及专业服务,以期与客户共同协作,加快研发及生产进度,为客户提供更多价值。ArcticZymes Technologies成立于20世纪80年代后期,总部位于挪威北部的特罗姆瑟(Tromsø)。
目前基因药物领域常用的病毒载体有腺病毒、慢病毒、重组腺相关病毒(rAAV)以及逆转录病毒等,其中AAV因其免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、表达稳定以及特异性强等优势脱颖而出。据NIH统计,已有超过200个正在进行或已完成的基因药物临床试验使用rAAV载体。尽管rAAV基因药物已显示出巨大的前景,但是强大、稳健而且可放大的基因载体生产制造工艺一直是CGT行业的痛点。目前rAAV生产平台主要有三种:三质粒瞬转体系(TransientTransfection, TT)、杆状病毒表达载体体系(Baculovirusexpression vector,BEV)和包装细胞体系(Packaging/Producercell line,PCL)。高盐浓度下,宿主DNA与蛋白质能够更高效解离,从而更容易被降解。云南上海倍笃生物高盐核酸酶
ArcticZymes厂家管控整个供应链及生产流程,协助客户进行文件审计及现场审计。云南500mM盐浓度条件高盐核酸酶
相比传统的Benzonase核酸酶,SAN HQ高盐核酸酶的优势是在400mM-600mM盐浓度条件下具有适宜酶活性。在这个条件下,AAV病毒载体聚集更少、更加稳定;SAN HQ的使用能够简化生产工艺、降低酶用量及成本,不需额外脱盐操作;AAV病毒载体得率更高,且HCD残留更少、AAV产物更稳定。曲光教授在2005年发表的文章中,以AAV2为例探讨了引起AAV病毒聚集的因素,并探索了AAV病毒纯化和制剂过程中抑制聚集的方法。该文章通过筛选发现,高盐浓度能够抑制AAV病毒团聚,让AAV病毒更加稳定,且高盐浓度并不削弱AAV病毒的侵染活性。云南500mM盐浓度条件高盐核酸酶