商机详情 -
IL-10免疫荧光分析
细胞免疫荧光实验常见问题:1、信号弱或者无信号:细胞或组织样本保存时间过长;2)抗体浓度不合适,参照抗体说明书的稀释浓度,再根据样本表达量进行摸索;3)一抗孵育时间不合适,建议 4 ℃ 过夜孵育。2、高背景:封闭不充分;抗体浓度过高;抗体孵育时间过长或温度过高;清洗不充分;样本变干,染色过程确保样品始终浸没于液体环境中.3、非特异性染色较多:固定液残留,这里需要缩短固定时间并且在封闭液中加甘氨酸,并且抗原修复也可以帮助解决非特异性染色;二抗残留,二抗需要用带有吐温 20 的 PBS 溶解,只要荧光显微镜的强度还可以增大,那么就可以增加吐温洗脱掉非特异性染色。免疫荧光在医学诊断中起着重要作用,可以用于检测病原体、肉瘤标志物等。IL-10免疫荧光分析
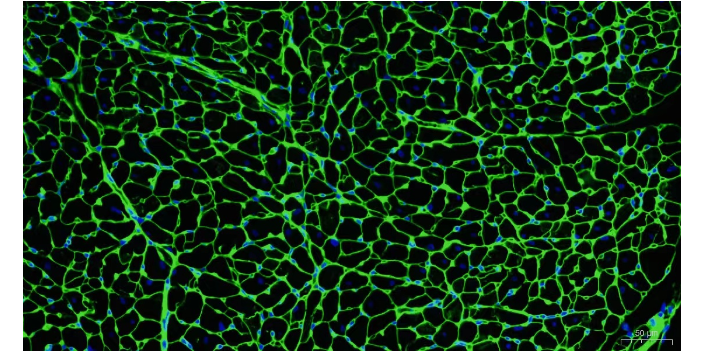
细胞免疫荧光可以观察蛋白在细胞中的定位,以及一些特殊信号分子蛋白的出核/入核的定位变化。在进行细胞免疫荧光过程中,需要用到细胞爬片,通过将爬片浸在细胞培养基内,细胞在爬片上生长,进而进行细胞的免疫荧光。实验前准备:1.胰酶;2.DMEM细胞培养基;3.细胞培养12孔板或者6孔板;4.爬片。间接免疫荧光的优点:通过增加能够与一抗结合的二抗数量进行信号放大;与直接免疫荧光相比,通过信号放大提高检测灵敏度。免疫荧光技术是一种以荧光素标记抗体来定位抗原物质的高度发达的标记免疫技术。IL-10免疫荧光分析荧光抗体技术具有高灵敏度和高特异性,可以实现精确的免疫检测。
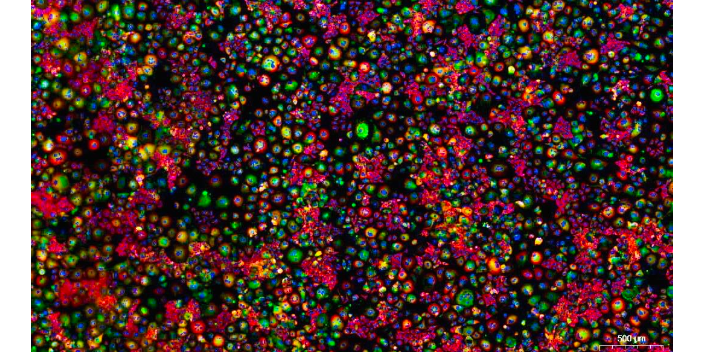
免疫荧光通透(目的是使抗体进入胞内),0.5%TritonX-100(一种去垢剂,用PBS配制)室温通透20min(针对胞内抗原,若是细胞膜上表达的抗原则省略该步骤);除了TritonX-100,也可作为通透剂,并且固定后的样品不需要通透。封闭(减少一抗和二抗与非特异位点进行结合),通透后用PBS浸洗玻片3次,每次3min,吸水纸吸干PBS,在玻片上滴加山羊血清,室温封闭30min。常用的封闭液包括:与二抗同一来源的血清、BSA或者是羊血清。从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。醛类固定的样品,在用一抗孵育前用含0.3M甘氨酸的封闭液进行封闭。
荧光抗体技术:抗原抗体反应后,利用荧光显微镜判定结果的检测方法。免疫荧光测定:抗原抗体反应后,利用特殊仪器测定荧光强度而推算被测物浓度的检测方法。免疫荧光实验步骤:直接法测抗原:基本原理:将荧光素标记在相应的抗体上,直接与相应抗原反应。其优点是方法简便、特异性高,非特异性荧光染色少。缺点是敏感性偏低;而且每检查一种抗原就需要制备一种荧光抗体。此法常用于细菌、病毒等微生物的快速检查和肾炎活检、皮肤活检的免疫病理检查。免疫荧光技术可以用于研究细胞凋亡和细胞存活。
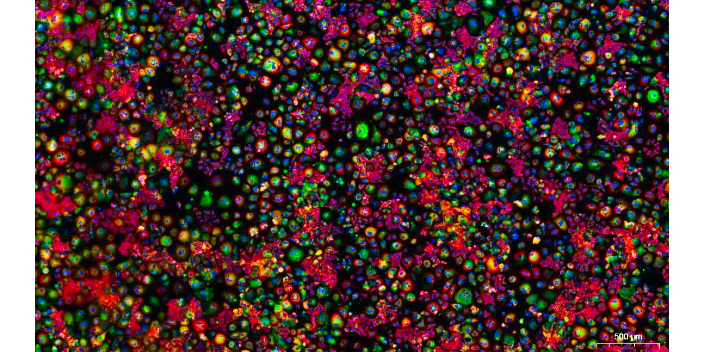
荧光的猝灭:荧光分子的辐射能力在受到激发光较长时间的照射后会减弱甚至猝灭,这是由于激发态分子的电子不能回复到基态,所吸收的能量无法以荧光的形式发射。一些化合物有天然的荧光猝灭作用而被用作猝灭剂,以消除不需用的荧光。因此荧光物质的保存应注意避免光(特别是紫外光)的直接照射和与其他化合物的接触。在荧光抗体技术中常用一些非荧的色素物质如亚甲蓝、碱性复红。伊文思蓝或低浓度的过锰酸钾、碘溶液等对标本进行得当复染,以减弱非特异性荧光本质,使特异荧光更突出显示。免疫荧光技术可以用于研究内脏移植和免疫抑制。S100A4免疫抗体
免疫荧光技术可以用于研究细胞信号传导和信号通路。IL-10免疫荧光分析
免疫学的基本反应是抗原-抗体反应。由于抗原抗体反应具有高度的特异性,所以当抗原抗体发生反应时,只要知道其中的一个因素,就可以查出另一个因素。免疫荧光技术就是将不影响抗原抗体活性的荧光色素标记在抗体(或抗原)上,与其相应的抗原(或抗体)结合后,在荧光显微镜下呈现一种特异性荧光反应。在此基础上又分为两种方法:直接法和间接法。直接法:将标记的特异性荧光抗体直接加到抗原上,经过一定时间反应,即可结合并显色。间接法:先用抗原的抗体(一抗)与抗原反应结合,再用荧光标记的二抗(一抗的抗体)与抗原反应,形成抗体-抗原-抗体复合物。IL-10免疫荧光分析