商机详情 -
正规外泌体提取试剂生产厂家
外泌体(Exosome)是细胞主动分泌的囊泡样小体,大小均一,直径30-200nm,密度1.10-1.18g/ml,来源普遍,几乎所有细胞都可分泌,在血液,尿液,唾液,脑脊液,腹水,乳汁等体液中普遍分布。外泌体较早在1986年发现于培养的绵羊红细胞上清液中。1996年,研究者发现外泌体作为抗原呈递因子参与T细胞依赖的抗一些病症反应,开启了外泌体蛋白研究的新天地。2013年诺贝尔生物/医学奖解答了细胞如何组织其内部较重要的运输系统之一——囊泡传输系统的奥秘。超离法因操作简单,获得的囊泡数量较多而广受?欢迎,但过程比较费时,且回收率不稳定,纯度也受到质疑。色谱法。这种方法分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不普遍。正规外泌体提取试剂生产厂家

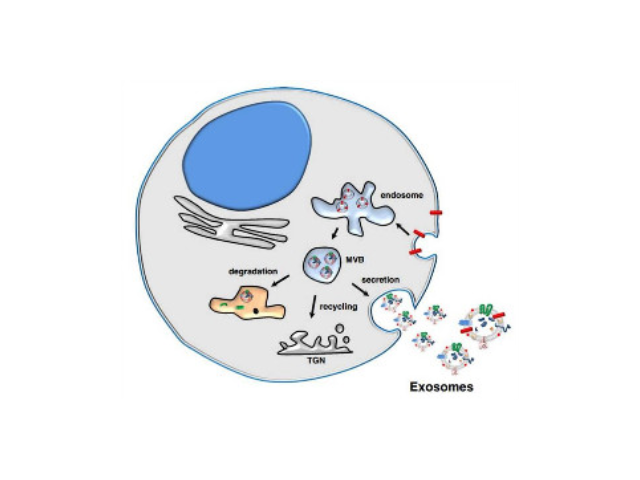
外泌体是一种存在于细胞外的多囊泡体,可通过细胞内吞泡膜向内凹陷形成多泡内涵体,内涵体与细胞膜融合后释放其中的小囊泡。外泌体的直径在40-110nm之间,其中包含RNA、蛋白质、microRNA、DN段等多种物质,存在于血液、唾液、尿液、脑脊液和母乳等多种体液中。外泌体从发现至今已有30多年的历史,虽然较初被认为可能是细胞的“垃圾”,所以才被排出来,但是近年来研究表明外泌体具有功能活性并可进行细胞间信息传递。如今,研究已经发现外泌体在抗原提呈细胞中呈递抗原程中、一些病症细胞发生的发展、神经细胞信号转导过程中都发挥着重要作用。正规外泌体提取试剂生产厂家由于外泌体的特殊结构和功能,使得它具有潜在的应用价值。
外泌体的提取、分离方法:微流控技术。微流控是利用微纳米级尺寸的管道来处理和操控流体所涉及的一门技术,其在外泌体分离方面的应用受到越来越多学者的关注。Jie等[16]课题组开发了一种三维纳米结构微流控芯片,微柱阵列通过化学沉积将交叉多壁碳纳米管功能化,然后其就可以识别特定的分子(CD63)并利用独特拓扑纳米材料高效的捕获外泌体。Wunsch等[17]利用硅工艺生产纳米级确定性侧向位移(Nano-DLD)芯片,得到了均匀的间隙尺寸,该芯片可以灵敏地将20~110nm的颗粒分离。该研究证明了外泌体基于大小的位移,从而揭示了利用芯片分选和量化纳米级生物胶体的潜力。
有的外泌体分离方法需要高速离心,需要使用大型机器,耗费近24小时的时间才能获得,非常不便。而高离心力也可能破坏囊泡。降低样品的质量。这项研究有望解决这一难题。在论文中,研究人员们提供了一种通过微流体和声学的独特组合从体液样品中捕获外泌体的新颖方法。他们开发的原始声学分选装置由两个倾斜的声学换能器和一个微流体通道组成,当这些传感器产生的声波相互碰撞时,形成产生一系列压力节点的驻波。每当细胞或颗粒流过通道并遇到一个节点时,压力会将细胞引导离开中心一点点。细胞移动的距离取决于大小和其他属性(如可压缩性),这样,当到达通道末尾时,不同大小和性质的细胞就能够被分离开来。这种方法分离得到的外泌体,基本上不改变其生物或物理特征,为开发评估人类健康以及疾病诊断和进展提供了有吸引力的新方法。外泌体提纯试剂盒的特色与优势:样本输入量多样。
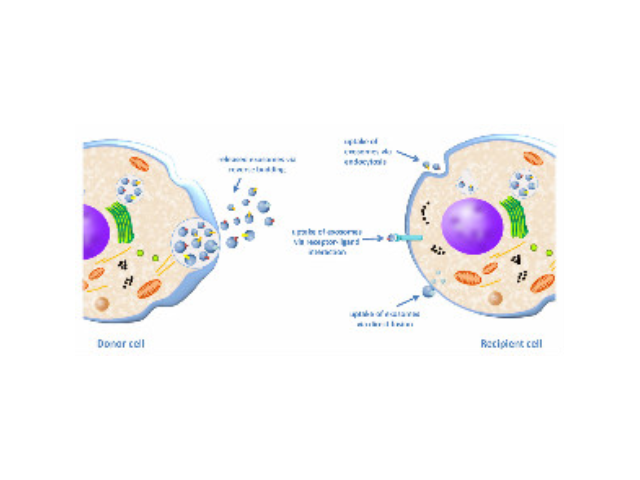
外泌体(exosome)是所有细胞释放出的细菌大小的颗粒。它们天然地存在于血液中。根据来自美国德州大学MD安德森一些疾病中心的一项新的研究,对外泌体进行基因操纵可能提供一种新的胰腺病治病方法。论文通信作者为德州大学MD安德森一些疾病中心一些疾病生物学系研究员RaghuKalluri博士。在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺病模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺病细胞中的KRAS突变基因,从而影响多种胰腺病模型的一些病症负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括病细胞)中。一方面可以作为诊断多种疾病的生物指标。正规外泌体提取试剂生产厂家
将沉淀物用PBS缓冲液进行悬浮,使外泌体悬浮于液体上层。正规外泌体提取试剂生产厂家
外泌体,是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40-100nm。尽管外泌体较初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物。然而较近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。较近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、一些病症的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。正规外泌体提取试剂生产厂家