商机详情 -
外泌体提取试剂进货价
人体内多种细胞及体液均可分泌外泌体,包括内皮细胞、免疫细胞、血小板、平滑肌细胞等。当其由宿主细胞被分泌到受体细胞中时,外泌体可通过其携带的蛋白质、核酸、脂类等来调节受体细胞的生物学活性。外泌体介导的细胞间通讯主要通过以下三种方式:一是外泌体膜蛋白可以与靶细胞膜蛋白结合,进而靶细胞细胞内的信号通路。二是在细胞外基质中,外泌体膜蛋白可以被蛋白酶剪切,剪切的碎片可以作为配体与细胞膜上的受体结合,从而细胞内的信号通路。有报道称一些外泌体膜上蛋白在其来源细胞膜上未能检测出。三是外泌体膜可以与靶细胞膜直接融合,非选择性的释放其所含的蛋白质、mRNA以及microRNA外泌体的提取分离:试剂盒提取。外泌体提取试剂进货价
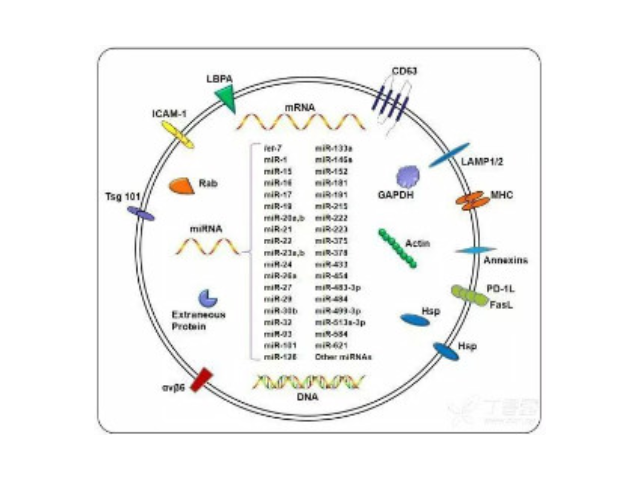
外泌体,是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40-100nm。尽管外泌体较初在1983年就被发现,但人们一直认为它只是一种细胞的废弃物。然而较近几年,人们发现这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。这些发现点燃了人们对细胞分泌膜泡的兴趣。较近的研究发现外泌体在很多生理病理上起着重要的作用,如免疫中抗原呈递、一些病症的生长与迁移、组织损伤的修复等。不同细胞分泌的外泌体具有不用的组成成分和功能,可作为疾病诊断的生物标志物。外泌体提取试剂进货价以提取尿液中的外泌体为例,每次至少需要200毫升的尿液量。

外泌体的提取、分离方法:开发高效、快速、稳定,并且保持外泌体结构和生物功能完整性的方法,是目前外泌体应用于临床的基础和前提。从细胞上清和体液中提取分离外泌体的方法很多,但是外泌体的纯度和产量却和分离方法息息相关。通常分离步骤少、产率高,但是纯度会受到影响。鉴于每种分离方法都有其优缺点,实验可以根据样本来源、下游实验目的等,选择合适的外泌体分离方法。2015年,国际囊泡组织(InternationSocietyforExtracelluarVesicles,ISEV)指出,简单依靠一种分离方法得到的外泌体的纯度和产量都难满足实验的需求。因此,推荐联合使用各种方法,从而得到高纯度和高产量的外泌体。
外泌体相关蛋白质与肺病的诊断:近年来众多文献报道,肺病细胞分泌的外泌体中富含多种蛋白质并促进肺病的发生的发展,是早期诊断肺病的有效途径。有研究发现,NSCLC患者肺组织外泌体表面EGFR免疫染色呈阳性的占80%,而慢性肺炎组织的外泌体EGFR呈阳性的只占2%,因而认为外泌体的EGFR蛋白可以用作NSCLC与慢性肺炎鉴别诊断的生物标志物。Park等通过Sys-BodyFlu-id数据库分析发现153种特异性胸腔积液外泌体蛋白质,进一步的Westernblotting分析显示多种特异性胸腔积液外泌体蛋白参与EGFR信号传导途径以促进一些病症的发生的发展,因此外泌体蛋白可能作为肺病诊断筛查的生物学标记物。近几年来,市场上已出现各种商业化的外泌体提取试剂盒。外泌体提取:超滤膜也可用于分离外泌体。
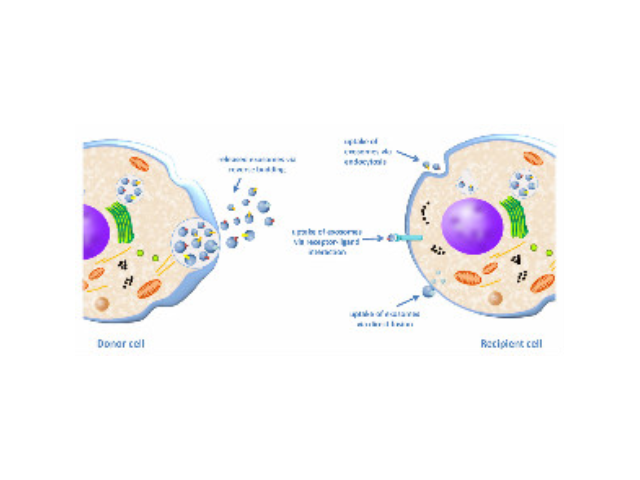
人体几乎所有类型的细胞都能分泌外泌体,外泌体普遍存在并分布于各种体液中,携带多种蛋白质、mRNA、miRNA和脂质类物质等,作为重要的传递信号分子,形成了一种全新的细胞-细胞间信息传递系统,可参与细胞通讯、细胞迁移、血管新生和一些病症细胞生长等过程。外泌体与微泡:我们知道,细胞间相互作用可以通过释放蛋白质、核酸、脂质等分子到胞外与受体结合从而介导胞内细胞传导。除此之外,细胞还可以释放膜囊泡,外泌体与微泡就是其中两种,二者相似但形成方式不同:外泌体是细胞内内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中的膜囊泡,而微泡则是细胞出芽与细胞膜融合后直接脱落形成的囊泡,且外泌体大小均一,直径在40~100nm,其大小取决于其起源部位以及细胞中的脂质双层结构;而微泡大小不一,直径在50~1000nm之间。唐山正规外泌体提取试剂产品介绍在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。严重阻碍了我国在外泌体的研究和临床应用上的发展。石家庄外泌体提取试剂单价
由于这些核酸被囊膜包裹而被保护,稳定性高,不易降解。外泌体提取试剂进货价
外泌体的提取分离:1、超速离心法(差速离心)。超离法是常用的外泌体纯化手段,采用低速离心、高速离心交替进行(如图所示),可分离到大小相近的囊泡颗粒。超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。2、密度梯度离心。在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。通过密度梯度离心,样品中的外泌体将在1.13-1.19g/ml的密度范围富集。此法获得的外泌体纯度较高,但步骤繁琐,耗时。外泌体提取试剂进货价