商机详情 -
济南外泌体提取试剂产品介绍
外泌体的提取主要包括以下几种方式。一是超速离心法,这是目前外泌体提取较常用的方法。此种方法得到的外泌体量多,但是纯度不足,电镜鉴定时发现外泌体聚集成块,由于微泡和外泌体没有非常统一的鉴定标准,也有一些研究认为此种方法得到的是微泡不是外泌体。二是过滤离心,这种操作简单、省时,不影响外泌体的生物活性,但同样存在纯度不足的问题。三是密度梯度离心法,用此种方法分离到的外泌体纯度高,但是前期准备工作繁杂,耗时,量少。外泌体检测作为一种新型的液体活检热点技术已被许多临床科研机构普遍地应用于一些病症和疾病的无创诊断。外泌体提取:密度梯度离心。济南外泌体提取试剂产品介绍
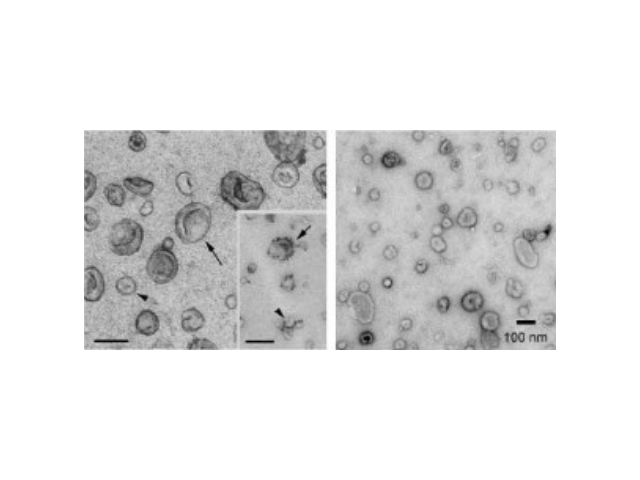
所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。无锡外泌体提取试剂推荐厂家由于这些核酸被囊膜包裹而被保护,稳定性高,不易降解。

1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键。
外泌体:该研究主要是做了牡蛎基因组测序,并揭示其应激适应和壳结构的复杂性。其中涉及,所鉴定的259种壳蛋白中的84%不是经典分泌蛋白;它们可能是细胞的一部分或被外泌体沉积而来。259个壳蛋白中的61个与外泌体数据库中的蛋白质匹配,支持了外泌体的存在。在矿化前缘处观察到含有方解石晶体的细胞和外泌体样囊泡,尽管它们在壳形成中的重要性是有争议的。这项研究为它们在壳内的存在及其可能参与壳形成提供了分子证据。Hedgehog(Hh)蛋白的保守家族作为短距离和长距离分泌的形态发生素,在胚胎发育过程中控制组织构型和分化。成熟的Hh携带疏水性棕榈酸和对其细胞外扩散至关重要的胆固醇修饰。色谱法。这种方法分离到的外泌体在电镜下大小均一,但是需要特殊的设备,应用不普遍。
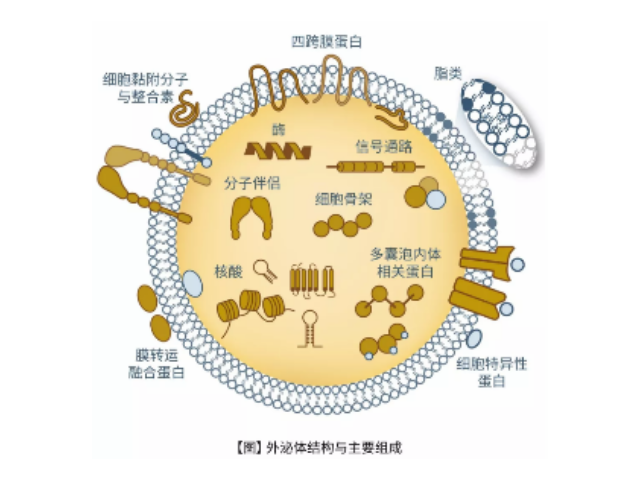
1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键外泌体的提取分离:PEG-base沉淀法。无锡外泌体提取试剂推荐厂家
将人尿液来源细胞的培养基通过0.22微米滤膜过滤,以去除大的细胞残片以及其它杂质。济南外泌体提取试剂产品介绍
2018版《指导要求》说明外泌体没有限定单一的分离手段,多种手段都可以进行细胞外囊泡的富集。《指导要求》编写者们认为“高回收率,低特异性”的富集手段是指那些富集囊泡的同时会有大量的非囊泡组分被富集,甚至细胞的整个分泌组都会被掺入其中,归入这一类的分离手段主要包括通过改变电荷或通过高聚物作用的沉淀试剂盒、低分子量截流的超滤分离、超长时间和超高离心力的超速离心等。Wako的MagCapture™ExosomeIsolationKitPS(产品编号299-77603(2tests),293-77601(10tests)),使用PS亲和法对外泌体进行提取,损失小且能获得高纯度的外泌体。济南外泌体提取试剂产品介绍