在动物实验中,给药的方式的选择与操作规范直接影响实验结果的准确性和动物福利。尾静脉注射、腹腔注射、灌胃是小鼠实验中常用的三种给药的方式,新手常因操作不当导致给药失败、动物损伤甚至实验数据偏差。下面就为大家带来超详细的实操技巧+避坑指南,新手也能快速上手!
尾静脉注射能使药物直接进入血液循环,起效快、生物利用度高,常用于快速给药、免疫细胞回输等场景。但因其操作精度要求高,是很多新手的“拦路虎”。
1. 主要操作技巧
小鼠固定是关键:选用小鼠固定器,将小鼠头部朝前放入,调整固定器松紧度,使尾部完全暴露且小鼠无法转身,让尾部自然下垂。若没有固定器,可用50ml离心管或者20ml注射器代替。固定时避免过紧导致小鼠窒息,过松则易挣扎。
尾部血管预处理:小鼠尾静脉有3条(背侧1条、腹侧2条),优先选择背侧静脉(较粗且易定位)。用75%酒精棉球反复擦拭尾部,利用酒精的温热效应扩张血管,同时去除尾部油脂便于进针。若血管不明显,可将尾部浸入37℃温水中1-2分钟,或用手指轻轻揉搓尾部促进血流。
进针姿势与角度:选用26-30G针头(根据小鼠年龄调整,幼鼠用30G),吸取药液后排空针管内气泡。持针姿势如握笔,针头斜面朝上,与尾部呈15-30°角,在尾部中1/3段进针(尾部前端血管较细,后端靠近肛门易污染)。进针时动作要轻,当感觉到“落空感”且推注药液无阻力、尾部无肿胀时,说明针头已进入血管。
推注与拔针:推注药液速度要缓慢均匀(根据药物性质调整,刺激性的药物更慢),同时观察小鼠状态。推注完毕后,用干棉球按压进针点3-5秒止血,避免药液外渗或出血。

2. 避坑注意事项
避免在尾部末端1/3段进针,此处血管细小易破裂;也不要反复在同一部位穿刺,以免形成血肿堵塞血管。
若推注时感觉阻力大、尾部出现发白或肿胀,立即停止推注并拔针,更换穿刺部位。
药液浓度不宜过高,避免结晶堵塞针头;油剂药物需加热至37℃左右再注射,防止刺激血管。
免疫缺陷小鼠(如NXG小鼠)尾部皮肤较薄,穿刺时力度要更轻,避免穿透血管壁。
腹腔注射通过腹膜吸收药物,操作相对简单,适用于多种药物给药,尤其适合对血管刺激性大或不易静脉注射的药物。但操作不当易损伤内脏,需格外注意。
1. 主要操作技巧
小鼠固定方式:注射时用左手拇指和食指捏住两耳及头皮,无名指和小指捏住尾巴,腹部朝上,把小鼠控制在手掌间。
进针部位定位:选择腹部左下腹或右下腹(避开正中线,此处有肝脏、膀胱等)。进针前用75%酒精棉球消毒皮肤。将针头由下腹部腹中线两侧朝头方向刺入腹腔。
推注与拔针:注射完毕拔针后停顿三秒,观察液体是否溢出,如若溢出,需从另一侧刺入重新注射。
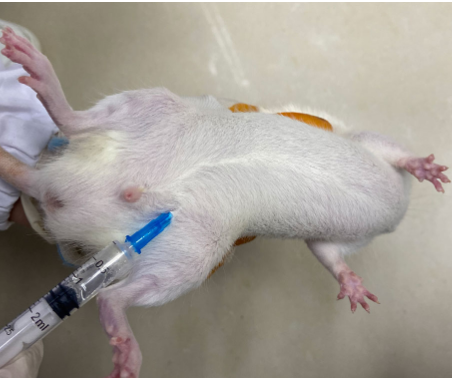
2. 避坑注意事项
禁止在腹部正中线进针,避免损伤肝脏、脾脏或膀胱(膀胱充盈时更易受损,注射前可轻压小鼠腹部促使排尿)。
进针深度不宜过深,尤其是幼鼠或消瘦小鼠,以免穿透腹膜损伤肠道。
油性的药物或混悬液需充分摇匀后注射,避免药物沉淀导致剂量不准确。
注射后观察小鼠状态,若出现精神萎靡、腹部肿胀或腹泻,可能是药液外渗或内脏损伤,需及时处理。
灌胃(胃内注射)能使药物直接进入胃肠道吸收,避免药物被口腔黏膜破坏,适用于需要经消化道给药或无法口服的小鼠。操作时需避免损伤食道和气管。
1. 主要操作技巧
工具准备:选用小鼠灌胃针(由针头和塑料导管组成,导管末端圆润,避免损伤食道),根据小鼠体重选择合适规格(10g以下小鼠用12G,10-20g用10G,20g以上用8G)。
小鼠固定技巧:左手拇指和食指捏住小鼠颈部皮肤,将小鼠身体向上提起,使头部与躯干呈一条直线(避免食道弯曲),保持小鼠稳定。
插针姿势与深度:将灌胃针连接注射器,吸取药液后排空气泡。用右手持灌胃针,从小鼠口腔右侧插入(避开牙齿),沿上颚缓慢插入食道。插入深度根据小鼠体重判断:10g小鼠约2cm,20g小鼠约3cm,30g小鼠约4cm。插入时若感觉阻力大,不要强行插入,需调整角度后再试。
推注与拔针:确认灌胃针未插入气管(可观察小鼠呼吸,若呼吸平稳无咳嗽,说明位置正确)后,缓慢推注药液。推注完毕后,轻轻旋转灌胃针后拔出,避免药液残留于食道。

2. 避坑注意事项
关键的禁忌:避免将灌胃针插入气管!若插入气管,推注药液会导致小鼠窒息死亡。判断方法:插入后观察小鼠呼吸,若出现剧烈咳嗽、呼吸困难,立即拔针。
灌胃针插入角度不宜过陡,避免损伤食道黏膜;也不要插入过深,以免损伤胃壁。
药液量不宜过多,成年小鼠单次灌胃量不超过1ml,幼鼠不超过0.2ml,避免引起呕吐或胃扩张。
具有强刺激性的药物不宜灌胃,以免损伤胃肠道黏膜;若药物为粉末,需充分溶解并过滤,避免颗粒堵塞灌胃针。
操作前准备:所有器械(针头、灌胃针、注射器)需高压灭菌;药物需按要求配制,明确剂量和浓度;提前熟悉小鼠状态,避开怀孕、患病或应激状态的小鼠。
剂量精确控制:根据小鼠体重计算给药剂量,使用微量注射器或移液枪确保剂量准确,避免因剂量误差影响实验结果。
动物福利保障:操作时动作轻柔,避免粗暴对待小鼠;固定时松紧适度,防止窒息或损伤;若需多次给药,应间隔适当时间,减少动物应激。
操作后观察:给药后观察小鼠精神状态、饮食、饮水及排泄情况,若出现异常反应(如抽搐、腹泻、体重骤降),及时记录并处理。
小提醒:新手建议先在模拟模型或处死的小鼠上练习,熟练掌握操作技巧后再进行实验。规范操作不仅能提高实验成功率,更是对实验动物的尊重与负责哦!