本研究通过3D生物打印技术构建预血管化组织,发现改变聚己内酯(PCL)框架大小可产生不同限制力,进而调控血管分支形成;其中Yes 相关蛋白(YAP) 参与该调控过程,且细胞 - 纤维蛋白条带宽度、力的大小与血管分支数量存在密切关联,表明工程化皮肤组织的血管化是可通过精确机械控制实现的复杂过程。

详细总结:
1. 研究背景与目的·
背景:血管网络质量是皮肤移植成功的关键,组织工程皮肤因血管化不足易出现缺血坏死,而预血管化是建立高质量血管网络的基础。现有技术难以精细调控血管分支形成,机械刺激被认为是潜在调控手段。
· 目的:利用 3D 生物打印技术,通过改变框架产生的限制力,调控血管分支形成,建立可控血管分支的组织模型。
2. 材料与方法
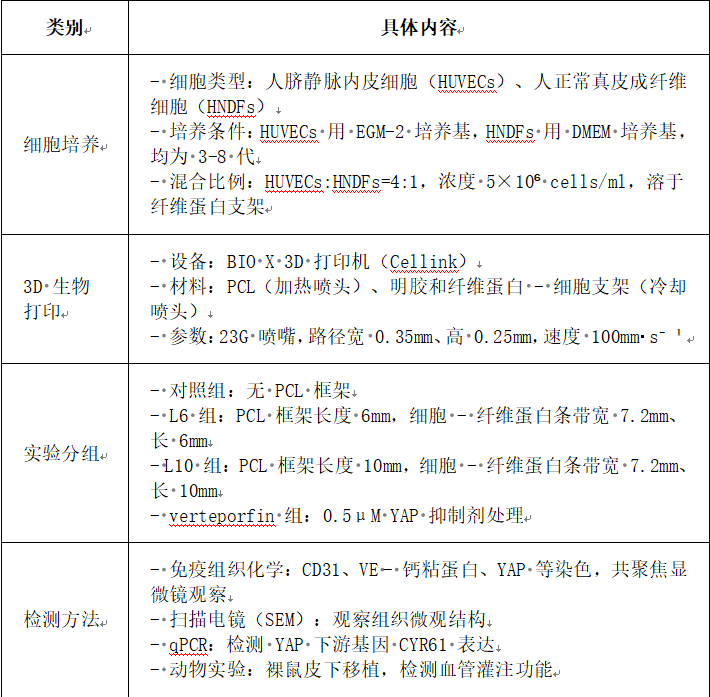
3. 实验结果·
血管分支与 PCL 框架的关系:
· L6 组(6mm 框架):血管呈弧形排列,分支数量多。
· L10 组(10mm 框架):血管接近线性排列,分支少或无。
· 对照组:血管分支无规律,长度和分支数***低于 L6 组。
· 限制力测量:
· 采用弹簧常数 51.7μN/μm 的微弹簧装置,L6 组限制力约 2.4mN,L10 组约 4.3mN。
· YAP 的调控作用:
· YAP 下游基因 CYR61 在 L6 组 6h 时表达高于对照组,verteporfin 处理后***降低。
· verteporfin 组血管分支数***多于未处理组,F-actin 排列与限制力方向不一致(图 5c、5d)。
· 组织特性:
· H&E 染色:L6 组组织厚度***大于对照组,随 PCL 框架增大,厚度增加(图 6a)。
· Masson 染色:L6 组胶原成熟度优于对照组,框架越大胶原越成熟(图 6b)。
· SEM:L6 和 L10 组细胞排列更紧密,接近正常真皮结构,L10 组细胞沿力方向排列(图 8)。
· 动物实验:移植 10 天后,新生血管有灌注功能,人源 ECs 形成的管腔中检测到红细胞和 FITC - 葡聚糖(图 S1)。
4. 讨论·
机械力通过影响细胞骨架(如 F-actin)调控血管形成,框架大小决定力分布,进而影响分支数量。
· YAP 作为机械信号转导分子,通过下游基因参与血管分支调控,与 F-actin 活性相关。
· 本模型为 3D 打印血管化组织提供新方法,但组织力学性能需改进以满足临床需求,力的大小与分支数量的关系需进一步研究。
5. 结论·
通过改变 3D 生物打印的PCL 框架大小可调控限制力,进而控制血管分支形成。
· YAP参与血管分支的调控过程。
· 细胞 - 纤维蛋白条带宽度、限制力大小与血管分支数量存在密切关联,该技术为构建可控血管网络的组织工程产品奠定基础。
关键问题
问题:本研究中如何通过 3D 生物打印技术实现对血管分支形成的调控?
答案:研究通过改变聚己内酯(PCL)框架的大小产生不同的限制力(框架越小,力分布呈弧形,分支多;框架越大,力越大,血管越接近线性,分支少),将细胞 - 纤维蛋白条带固定于框架中,利用细胞收缩与框架抵抗产生的限制力,实现对血管分支形成的调控,无需额外设备。
问题:Yes 相关蛋白(YAP)在血管分支形成调控中扮演什么角色?
答案:YAP 参与血管分支形成的调控:L6 组 YAP 下游靶基因CYR61表达高于对照组;使用 YAP 抑制剂(verteporfin)后,CYR61 表达降低,血管分支数***增加,F-actin 和血管生长方向与限制力方向不一致,表明 YAP 通过转导机械信号,影响下游基因表达,进而调控血管分支形成。
问题:本研究构建的预血管化组织在临床应用中有何潜力与挑战?
答案:潜力在于可通过精确机械控制构建具有高质量血管网络的组织工程皮肤,移植后能快速与宿主血管吻合,提高移植存活率,且可用于血管相关药物研发。挑战在于当前组织机械性能不足,难以直接应用于临床;此外,力的大小与血管分支数量的具体量化关系仍需深入研究,以优化组织构建参数。
关注我们了解更多内容

Cellink 认证的中国授权经销商:

上海迹亚国际商贸有限公司
Gaia China Co.,Ltd.