商机详情 -
杭州生物试剂进口清关手续
生物试剂进出口领域存在多种国际合作模式。一种是跨国企业间的联合研发合作,例如欧美药企与亚洲生物试剂企业合作,利用欧美企业的研发资金和技术优势,结合亚洲企业的人力成本与市场资源,共同开发新型生物试剂,研发成果通过双方进出口渠道推向全球市场。另一种是技术授权合作模式,拥有先进生物试剂技术的企业将技术授权给其他国家企业,被授权企业负责本地化生产与销售,技术授权方则通过收取授权费和销售分成获利,促进生物试剂技术在国际间流动与产品进出口。还有产业园区合作模式,不同国家共建生物产业园区,园区内企业共享资源、技术和市场,在生物试剂进出口方面形成产业集群优势,提升整体国际竞争力,推动生物试剂进出口业务协同发展。出口生物试剂要注意进口国对其有效期的相关限定规则。杭州生物试剂进口清关手续

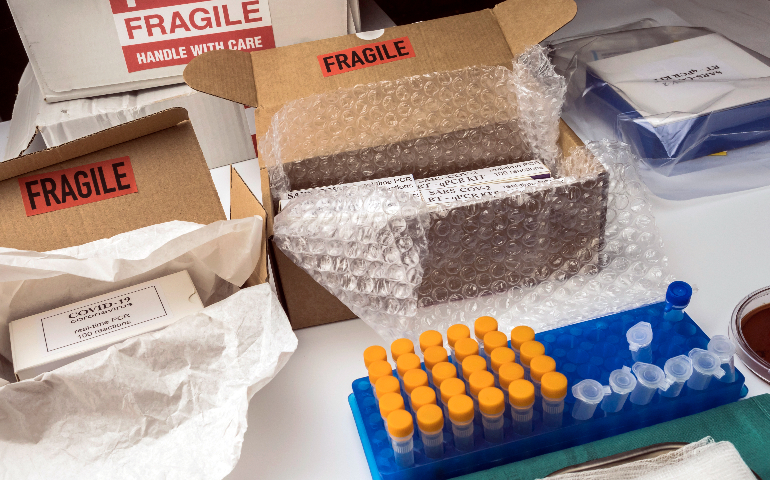
包装和标识在生物试剂进出口中举足轻重。包装材料要坚固耐用,且能适配试剂特性。强酸强碱类试剂要用耐腐蚀性包装,对光照敏感试剂需采用遮光包装,同时包装要具备良好密封性,防止泄漏。标识方面,必须清晰标注产品名称、成分、规格、生产企业、生产日期、有效期、储存条件、使用说明等信息。语言要符合目标市场要求,一般需用英语,在部分非英语国家,可能还得翻译成当地语言。对于危险生物试剂,要依据国际标准张贴危险货物标识,以此保障运输、储存和使用过程中的安全,避免因包装标识不当引发安全事故或通关受阻。杭州生物试剂进口清关手续出口生物试剂需对产品进行符合国际标准的预包装处理。
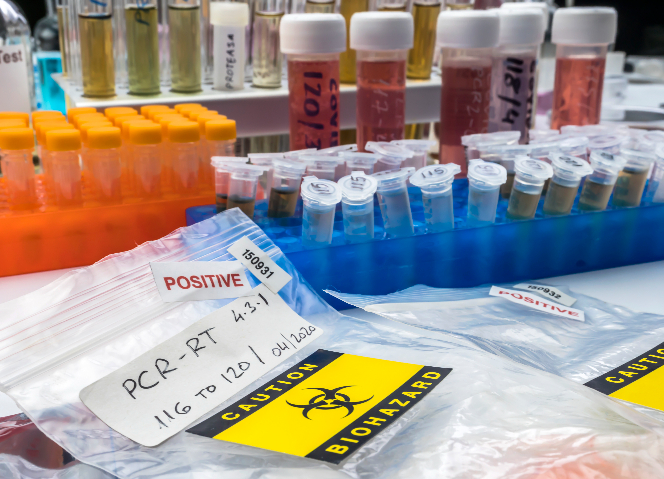
对于特殊生物制品类生物试剂,如疫苗类、血液制品类及血源筛查用诊断试剂等,进口审批更为严格。进口企业必须提前向国家药品监督管理局申请进口批件。申请时,需提供产品的详细信息,包括生产工艺、质量标准、稳定性研究数据、临床使用情况等资料,以证明产品质量可靠、安全有效且符合国内需求。国家药品监督管理局会组织人员对申请资料进行多方面审评,只有在获得进口批件后,企业才具备此类生物试剂的进口资格,防止不合格或高风险特殊生物制品流入国内。
质量管控贯穿生物试剂进出口全程。生产环节,出口企业要遵循严格质量标准,如国际标准化组织(ISO)相关质量管理体系要求,从原材料采购开始把控,确保其符合纯度、活性等指标。生产过程在符合 GMP 的洁净车间进行,防止微生物污染。产品出厂前经过多轮质量检测,包括物理性质、化学组成、生物活性测定等。进口企业在接收货物时,也需进行严格验收,对照合同与质量标准,检查试剂外观、包装完整性,抽样进行质量复核。若发现质量问题,及时与供应商沟通协商退换货。海关在查验时,对生物试剂质量也会抽检,确保进口产品符合我国质量要求,保障国内科研、医疗等领域使用安全。生物试剂进口申报需准确填写试剂的详细成分与用途说明。
全球生物试剂市场规模庞大且持续增长。在科研领域,生命科学研究不断深入,对生物试剂需求日益旺盛,推动市场扩张。欧美地区科研投入高,是主要消费市场,拥有众多有名生物试剂企业,技术先进、产品线丰富。亚洲地区,随着经济发展和科研实力提升,特别是中国、印度等国家,市场潜力巨大,需求增速高于全球平均水平。从产品类型看,分子生物学试剂、免疫诊断试剂等细分市场占据较大份额。在进出口贸易中,发达国家多为不错生物试剂出口国,凭借技术优势把控重心产品供应;发展中国家在中低端产品领域有一定竞争力,同时也是不错试剂重要进口市场。企业需结合市场趋势,找准定位,制定合适进出口策略,开拓市场份额。出口生物试剂需准备好应对进口国抽检的相关材料。昆山核酸试剂进出口关税政策
出口生物试剂时,运输包装需符合国际生物运输的安全标准。杭州生物试剂进口清关手续
特殊生物试剂进口有着更为严苛的政策。高风险生物制品类试剂,如某些用于血液筛查的诊断试剂,除满足常规进口要求外,还需依据《生物制品批签发管理办法》,在进口前取得生物制品批签发证明,确保每批次产品质量安全。涉及人类遗传资源的生物试剂进口,受《中华人民共和国人类遗传资源管理条例》监管,进口单位需提前申请人类遗传资源许可,防止我国人类遗传资源非法外流,同时保证试剂用于合法科研、医疗等用途。此外,对于含有毒有害物质或受管控生物因子的生物试剂,需符合环保、生物安全等多部门联合制定的进口政策,履行相应审批与监管流程。杭州生物试剂进口清关手续